Хронический гепатит В (HBV-инфекция) продолжает оставаться весьма актуальной медико-социальной проблемой, что связано с весьма широким его распространением, возможностью развития цирроза печени и гепатоцеллюлярной карциномы. Справедливости ради следует отметить, что нарастающие темпы всеобщей вакцинации в отношении HBV-инфекции все же дали положительный результат, и случаи острой HBV-инфекции в настоящее время выявляются значительно реже по сравнению, например, с периодом 10-15-летней давности . Однако вакцинация — это мероприятие, направленное прежде всего на ликвидацию «новых» случаев HBV-инфекции. При этом очевидно: существует огромная популяция населения, уже инфицированная когда-то и являющаяся, во-первых, потенциальным источником возможного инфицирования других людей, во-вторых, тем контингентом населения, где существует несравненно более высокий риск дальнейшего развития заболеваний печени, потребующих в будущем огромных экономических и интеллектуальных затрат от общества, направленных на их возможное излечение. Вот почему в настоящее время чрезвычайно важной является разработка наиболее эффективных и безопасных способов лечения хронического гепатита В .
Первым препаратом, использованным для лечения хронического гепатита В, был «короткий» интерферон, до сих пор являющийся официально зарегистрированным средством терапии данного заболевания во многих официальных международных стандартах лечения; его использование в дозе 5-6 MU ежедневно или в дозе 9 MU через день сопровождалось у части пациентов стойкой нормализацией уровня аланиновой трансаминазы (АЛТ), подавлением репликации ДНК вируса гепатита В (HBV DNA) до неопределяемого уровня. При этом было отмечено, что эффективность данного лечения сопряжена с такими факторами, как клинико-лабораторная активность заболевания, выраженность сопутствующего фиброза на старте лечения, генотипа HBV, а также иммунологического профиля по «е»-антигену (HBeAg-позитивный или HBeAg-негативный варианты). К настоящему времени уже накоплен достаточный опыт использования «короткого» интерферона при хроническом гепатите В. При этом стало очевидным, что результаты такого лечения сопряжены с невысоким уровнем стойкого ответа, невысокой частотой сероконверсии по «е»-антигену, если речь идет о HBeAg-позитивном варианте. Еще менее утешительными были результаты достижения конверсии по «s»-антигену, когда у пациента после терапии исчезал HBsAg и появлялись антитела к нему (anti-HBs) . Кстати, еще до недавнего времени появление anti-HBs традиционно связывали с «полным выздоровлением» . Однако последние достижения вирусологии, молекулярной биологии, совершенствование методов диагностики позволили констатировать тот факт, что даже у этих пациентов в ряде случаев продолжает определяться HBV DNA. При этом стало очевидным и то, что проведенная противовирусная терапия «короткими» интерферонами, пусть даже и «неуспешная» с точки зрения вирусной кинетики (отсутствие сероконверсии, продолжающаяся репликация HBV), ассоциирована с достоверно меньшими темпами прогрессирования болезни и положительной гистологической динамикой. Очевидно, назрела необходимость поиска новых препаратов, эффективных в отношении HBV-инфекции, а также безопасных и доступных для пациентов .
В настоящее время для лечения хронического гепатита В применяют два класса противовирусных средств — нуклеозидные аналоги, или аналоги нуклеотидов (по аналогии с ВИЧ-инфекцией), и интерфероны («короткие» и пегилированные). Первым из нуклеозидных аналогов, официально зарегистрированных для лечения хронического гепатита В, стал ламивудин (Эпивир ТриТиСи, Зеффикс). Первый опыт лечения хронического гепатита В данным препаратом в стандартной дозе 100 мг/сут однократно внушал оптимизм: в опытах in vitro и in vivo препарат очень быстро блокировал HBV-полимеразу; при этом препарат практически лишен митохондриальной токсичности, свойственной многим нуклеозидным аналогам . Но постепенно, по мере накопления практического опыта использования этого препарата у пациентов с хроническим гепатитом В, стало формироваться объективное представление о его клинической эффективности. Так, например, стала очевидной относительно невысокая частота достижения сероконверсии по «е»-антигену — немногим чуть более 20% на первом году лечения. При более продолжительном использовании препарата этот показатель возрастал; однако очень часто (до 68% случаев) к завершению пятилетнего периода от начала лечения ламивудином выявлялся специфически мутировавший вариант HBV-YMDD, ассоциированный с низким контролем над репликацией и продолжающейся прогрессией заболевания . Что касается возможности достижения конверсии по «s»-антигену на фоне лечения хронического гепатита В ламивудином, были получены данные, показавшие, что частота сероконверсии не превышает таковую за пятилетний период наблюдения в группе контроля среди пациентов с «естественным» течением болезни, т. е. без лечения. Отмечая «плюсы» лечения хронического гепатита В ламивудином, следует упомянуть о благоприятном его влиянии на некрозовоспалительную активность процесса. Однако было установлено, что темпы гистологически подтвержденного уменьшения некрозовоспалительной активности напрямую коррелируют с темпами подавления репликации HBV; при появлении же YMDD-варианта HBV достижение морфологического улучшения становится проблематичным. Данное обстоятельство послужило основанием для рекомендаций терапии ламивудином хронического гепатита В на стадии декомпенсированного цирроза печени и в посттрансплантационный период .
Вскоре после подтверждения возможности блокирования HBV-полимеразы вируса ламивудином появляются если не сотни, то уж точно десятки нуклеозидных аналогов, потенциально претендующих на лидерство в отношении эффективности (и безопасности) в радикальном решении вопроса терапии HBV-инфекции. Некоторые исследователи даже заговорили о новой — «безынтерфероновой» — эре терапии хронического гепатита В. Однако многие из «перспективных» молекул нуклеозидных аналогов, которые могли бы потенциально использоваться в препаратах для лечения хронического гепатита В, так и не стали применяться по многим причинам, в том числе в связи с высокой митохондриальной токсичностью, быстрым развитием специфических мутантных форм HBV, перекрестной резистентностью. Таким образом, приход «безынтерфероновой» эры лечения хронического гепатита В, по-видимому, откладывается. Более того: по мнению г-на Viki Sato, крупнейшего специалиста в разработке противовирусных средств, высказанному в 2006 г. в личной беседе с автором статьи, дальнейшая ставка на разработку препаратов, блокирующих HBV-полимеразу вируса гепатита В, по-видимому, является неким если не тупиковым, то к настоящему времени почти исчерпавшим себя направлением поиска средств эффективного лечения хронического гепатита В. Интересными и перспективными в этом смысле, как считает г-н Sato, могут быть поиск и разработка эффективных терапевтических вакцин, иммуномодулирующих средств. И все же как минимум два нуклеозидных аналога займут свое место в перечне лекарственных средств в терапии хронического гепатита В: адефовира дипивоксил (Гепсера) и энтекавир (Бараклуд). Первый препарат уже зарегистрирован практически по всему миру (за исключением стран Восточной Европы), второй же официально зарегистрирован для лечения хронического гепатита В пока лишь в США и Китае. Сразу отметим, что данные препараты являются перспективными прежде всего там, где развивается устойчивость к ламивудину.
Адефовира дипивоксил (Гепсера) — препарат, эффективность которого не зависит от активности внутриклеточных киназ. Он характеризуется относительно невысокой противовирусной активностью: снижение уровня HBV DNA более чем на 3log отмечается у пациентов в среднем через 48 нед от начала терапии. Адефовира дипивоксил относительно хорошо переносится, но обладает потенциальным нефротоксическим эффектом. В связи с этим уже на этапе проведения клинических испытаний стало ясно, что доза препарата не должна превышать 10 мг/сут ввиду возможного развития поражения почек (первоначально позиционировались две дозы — 10 и 30 мг/сут). Сероконверсия HBeAg в anti-HВe на фоне лечения адефовира дипивоксилом невысока у нелеченных ранее пациентов и составляет немногим более 12%, однако более длительные сроки использования препарата ассоции-рованы с большей частотой сероконверсии, хотя эти данные еще нуждаются в уточнении. Если говорить о сероконверсии по «s»-антигену на фоне лечения пациентов адефовира дипивоксилом, следует отметить, что она составляет лишь 5% в течение 5 лет лечения, что практически сопоставимо со спонтанной сероконверсией . К настоящему времени накоплен материал о позитивном влиянии адефовира дипивоксила на морфологические проявления гепатита В при пятилетнем его использовании: было показано, что у пациентов с хроническим гепатитом В вне зависимости от иммунологического профиля по «е»-антигену применение Гепсеры ассоциировано с 50%-ной редукцией мостовидного фиброза и уменьшением выраженности некровоспалительной составляющей гепатита. Кроме того, следует отметить, что при использовании адефовира дипивоксила, особенно в первые 2 года лечения, практически не наблюдается специфической мутации HBV (0-2%), однако уже к концу 4‑го года лечения подобная специфическая мутация отмечалась у 18% пациентов (в сравнении с ламивудином на этом сроке — до 70%) . Все эти свойства препарата Гепсеры и определили основной круг для его приложения среди больных хроническим гепатитом В — это пациенты с клинической и генетической резистентностью к ламивудину. Что касается чисто клинической категории пациентов, то это больные с практически любой морфологической стадией болезни и пациенты, перенесшие трансплантацию печени. Нормализация биохимических показателей крови при назначении адефовира дипивоксила у «правильно» отобранных пациентов может составлять до 65% как у HBeAg-позитивных, так и у HBeAg-негативных пациентов. При этом отмечено, что максимальная нормализация уровня АЛТ отмечается у больных в первые 2 года лечения; впоследствии ее показатель становится ниже, что, вероятно, связано с развитием специфической мутации HBV, вызванной адефовира дипивоксилом.
Энтекавир (Бараклуд) — еще один нуклеозидный аналог, официально рекомендуемый для лечения хронического гепатита В. Препарат со сложным механизмом действия: это и праймирование HBV-полимеразы, и обратная транскрипция негативной цепи DNA в прегеномной RNA, а также синтез позитивной цепи DNA. В ходе прошедших и еще продолжающихся клинических испытаний препарат продемонст-рировал свою клиническую эффективность в отношении «дикого» штамма HBV, а также ламивудин-резистентного штамма. При этом доза препарата у ранее нелеченных пациентов составляет 0,5 г/сут, а у пациентов с развитием резистентности к ламивудину — 1,0 г/сут. Назначение энтекавира у пациентов с хроническим гепатитом В сопровождается очень быстрым подавлением репликации HBV DNA, чуть более замедленной нормализацией АЛТ. К 96-й неделе терапии клиренс HBV DNA регистрируется почти у 80% HBeAg-позитивных пациентов, сероконверсия по «е»-антигену в этот период составляет в среднем 32%, еще через 24 нед наблюдения после окончания лечения было отмечено снижение числа пациентов с отрицательными тестами детекции HBV DNA — этот показатель снизился до 31%, в то время как число пациентов с сероконверсией по «е»-антигену возрастает почти до 70% . Более чем у 60% пациентов с хроническим гепатитом В и развитием резистентности к ламивудину назначение энтекавира сопровождается полной нормализацией уровня АЛТ, у 8-10% из них возможна и сероконверсия по «е»-антигену. К несомненным достоинствам энтекавира можно отнести его хорошую переносимость, низкую частоту серьезных побочных эффектов и самое главное — низкую частоту развития мутаций HBV в первые 2 года лечения, которая составляет немногим более 8%. При этом, конечно, следует учитывать, что с более длительным опытом использования энтекавира могут измениться наши представления и на этот счет (гипотетически вполне возможно значительное нарастание частоты специфической мутации HBV на фоне более длительной терапии хронического гепатита В) . Особенности фармакокинетики, фармакодинамики и данные о клинической эффективности как энтекавира, так и адефовира дипивоксила предопределили основную область его использования — пациенты с хроническим гепатитом В на любой морфологической стадии (особенно, когда развивается специфическая резистентность к ламивудину). Таким образом, энтекавир и адефовира дипивоксил вполне законно можно отнести к препаратам «второго» ряда, которые все же пока лучше рекомендовать пациентам, «потерпевшим неудачу» в лечении ламивудином .
В последнее время внимание клиницистов вновь стали привлекать интерфероны в качестве приложения к лечению хронического гепатита В, а именно их пегилированные аналоги (Пегинтрон, Пегасис). Возвращение интереса к назначению пегилированных интерферонов альфа при хроническом гепатите В, с учетом особенности их фармакодинамики и фармакокинетики, стало вполне логичным. Полученные результаты использования пегилированных аналогов интерферонов альфа у пациентов с хроническим гепатитом В позволили констатировать их высокую, если сравнивать с нуклеозидными аналогами, клиническую эффективность. Сероконверсия по «е»-антигену на фоне лечения пегилированными интерферонами составляет около 75%, а сероконверсия по «s»-антигену — до 9% (по данным некоторых исследований). Но, пожалуй, самым важным аргументом в пользу назначения пегилированных аналогов интерферона альфа при хроническом гепатите В являются данные о морфологической динамике процесса: уже на 48-й неделе применения уменьшение некровоспалительной активности отмечено более чем у 78% пациентов, а фиброза — более чем у 60% . Это самые высокие показатели положительной морфологической динамики на фоне различных режимов лечения хронического гепатита В. Ни у одного пациента с хроническим гепатитом В, получавшего пегилированные интерфероны альфа, не было описано случаев специфических мутаций HBV. Это обстоятельство послужило основанием для изучения эффективности комбинированной терапии «пегилированный интерферон альфа + нуклеозидный аналог» у пациентов с хроническим гепатитом В. Полученные результаты, однако, разочаровали исследователей: было показано, что монотерапия пегилированным интерфероном альфа ничуть не уступает по эффективности комбинированному режиму лечения. Долгое время считалось, что назначение интерферонов альфа и их пегилированных аналогов зависело от развития цирроза печени как у больных с хроническим гепатитом В, так и гепатитом С. Однако в последнее время стало совершенно очевидным, что назначение интерферонов альфа возможно и в этом случае, только необходимо использовать существенно более низкие их дозы. К настоящему времени уже проводятся как минимум шесть многоцентровых международных исследований, призванных изучить профиль безопасности и клиническую эффективность применения малых доз пегилированных интерферонов альфа как при хроническом гепатите С, так и при хроническом гепатите В (90 мкг однократно в неделю для пегилированного интерферона альфа-2а и 50 мкг однократно в неделю для пегилированного интерферона альфа-2b). Промежуточные результаты этих исследований позволяют констатировать, что приблизительно у 40% пациентов ко второму году лечения удается добиться не только стабилизации клинических симптомов заболевания, но и морфологического регресса.
Выбор рациональной тактики проведения противовирусной терапии хронического гепатита В остается для практикующего врача в настоящее время чрезвычайно сложной и архиважной задачей. Ее решение зависит от опыта и знаний врача, доступности того или иного конкретного препарата в регионе, знания клинических особенностей течения основного заболевания. Бурное развитие биомедицинских технологий в последнее время, безусловно, приведет к появлению не только новых препаратов уже известных классов лекарственных средств, но и новых лекарственных групп, объединенных принципиально иными механизмами, призванными элиминировать HBV. При этом очевидно, что имеющиеся уже сегодня лекарст-венные препараты при правильном и обоснованном их назначении позволяют надежно контролировать развитие хронического гепатита В, значительно замедляя темпы его прогрессирования и улучшая качество жизни пациентов.
По вопросам литературы обращайтесь в редакцию.
И. Г. Никитин
, доктор медицинских наук, профессор
РГМУ, Москва
HBV-инфекция - самая распространенная инфекция в мире. По данным ВОЗ, в мире насчитывается 200 млн носителей вируса гепатита В, ежегодно отмечается 2 млн летальных исходов у больных с HBV-инфекцией.
Решающим фактором расширения представлений о вирусном гепатите В явилось обнаружение в 1963 г. поверхностного антигена вируса гепатита В-HBsAg. Blumberg и соавт., изучая полиморфизм протеинов сыворотки крови, обнаружили, что у двух больных гемофилией она реагирует с сывороткой австралийского аборигена и при этом образуются линии преципитации. Антиген, содержавшийся в сыворотке этого индивидуума, не был идентичен какому-либо из исследуемых протеинов и получил название «австралийский антиген». Широкие исследования в разных частях света показали, что частота выявления этого антигена варьирует. Его часто обнаруживали при гемобластозах и синдроме Дауна. Решающее значение имели исследования, доказавшие, что этот антиген является маркером вирусного гепатита B.
HBsAg существует в виде разных структур: как оболочка округлых частиц HBV с диаметром 42 нм (частицы Дейна), имеющих 27-нанометровое электронно-плотное ядро; как округлые и тубулярные образования с диаметром 20 нм. Последние два вида частиц не являются инфекционными, они состоят только из белка HBsAg и являются материалом, избыточно синтезируемым инфицированными HBV клетками печени.
Вслед за инфицированием клеток вирусом часть генома HBV инкорпорируется в геном клетки хозяина. Инкорпорированная ДНК HBV является ответственной за синтез протеина, несущего детерминанты HBsAg. Концентрация малых частиц HBsAg в плазме в начале острого гепатита B много выше, чем частиц полного вируса. При других формах HBV-инфекции концентрация малых частиц HBsAg также много выше, чем концентрация вируса. Концентрация малых частиц HBsAg в плазме в большинстве случаев так высока, что HBsAg может быть обнаружен низкочувствительными методами, как, например, методом реакции преципитации в геле по Оухтерлони.
Методы идентификации . В настоящее время HBsAg рутинно выявляют в сыворотке методом иммуноферментного анализа. Это позволяет определить HBsAg в слюне, сперме, других биологических жидкостях человека, в которых концентрация HBsAg много ниже, чем в сыворотке. Малочувствительная реакция преципитации еще применяется для тестирования сывороток. Тест ВИЭФ приблизительно в 10 раз более чувствителен, чем реакция по Оухтерлони. В тесте ВИЭФ используют то обстоятельство, что HBsAg подвижен, как альфа-2-глобулин, в направлении катода, т. е. навстречу антителам, которые в агарозе передвигаются в направлении анода.
Методом иммунофлюоресценции HBsAg может быть определен в цитоплазме и клеточной мембране гепатоцитов, а также в других тканях (стенки сосудов, петли клубочков почек).
Иммунные реакции по отношению к гепатиту B . Все три упомянутых антигена индуцируют синтез соответствующих антител, которые могут быть обнаружены чувствительными методами и имеют большое клиническое значение.
Антитела к HBsAg появляются почти во всех случаях выздоровления после острого гепатита B. Обычно они определяются через несколько недель после нормализации трансаминаз и исчезновения HBsAg (серологическое «окно»). Присутствие анти-HBs означает выздоровление от HBV-инфекции, наличие иммунитета и отсутствие инфекционности. Наличие анти-HBs исключает дальнейшую репликацию HBV и диагноз хронического гепатита В или переход в будущем в хронический гепатит. Анти-HBs могут появиться в следующих ситуациях:
После перенесенной HBV-инфекции, чаще всего острой, но также и после хронического персистирующего гепатита, заканчивающегося выздоровлением;
После спонтанной иммунизации без инфекции - состояния, которое серологически отличается от предыдущего тем, что отсутствуют анти-НВс;
После пассивной или активной иммунизации.
Цель вакцинации в том, чтобы в организме продуцировались эти протективные антитела. Вакцина состоит из очищенных частиц HBsAg, которые получены из плазмы здоровых HBsAg-носителей (первое поколение) или из материала, продуцируемого с помощью генной технологии (второе поколение). Хотя HBsAg является слабым антигеном, возможно добиться проявления иммунного ответа при введении лишь 5 мкг препарата у 96 % вакцинированных. Количественное определение антител, производимое в сравнении со стандартом ВОЗ в международных единицах, - единственный критерий оценки разных вакцин и их дозы, а также схем иммунизации.
Анти-HBs играют предположительно опосредованную патогенетическую роль посредством образования иммунных комплексов. Хотя они выявляются в плазме только после исчезновения HBsAg, их синтез начинается уже во время инкубационного периода. Только значительный избыток антигена препятствует серологическому выявлению антител. Избыток антигена объясняется синтезом HBsAg в печеночных клетках во 2-й половине инкубационного периода. Циркулирующие иммунные комплексы, содержащие HBsAg, выявляются на последних неделях инкубационного периода и в первые дни острой фазы болезни. Эти ИК являются ответственными за нередкое возникновение симптомов сывороточной болезни (артриты, миалгии, зуд, уртикарии, отек Квинке, лихорадка, лейко- и тромбоцитопении и т. д.) в этом периоде заболевания. Эти же иммунные комплексы обусловливают развитие редких и возникающих на поздних стадиях заболевания экстрапеченочных проявлений HBV-инфекции (гломерулонефрит , васкулит). ИК не играют роли в возникновении повреждения клеток печени; увеличение их концентрации в циркуляции сопровождается снижением содержания общего комплемента или С4.
Клеточный иммунный ответ к HBsAg определяется при проведении реакции торможения миграции лейкоцитов и бласттрансформации, а также в цитотоксических исследованиях. Клеточный иммунный ответ, направленный на HBsAg, опосредует процесс цитолиза гепатоцитов, в мембрану которых интегрирован HBsAg, а также принимает участие в реакциях элиминации вируса гепатита В. Типичным является отсутствие этого иммунного ответа у здоровых носителей HBsAg. У больных хроническим гепатитом B выраженность клеточных иммунных реакций значительно снижена.
Итак, Т-клеточный иммунный ответ опосредует элиминацию вируса из печени, а гуморальный ответ (анти-HBs)-элиминацию вируса из крови.
Важнейшие иммунологические показатели при разных формах гепатита B . При остром гепатите B HBsAg обнаруживается в продромальном периоде и достигает максимальной концентрации за несколько дней до повышения активности ферментов. Антигенемия не коррелирует с тяжестью заболевания. При неосложненном течении HBs Ag исчезает из сыворотки в течение 10 недель.
В 90-95% случаев наступает выздоровление, при котором в сыворотке присутствуют три вида антител (только IgG класса). Иногда определенный вид антител не выявляется через некоторое время. Во многих случаях острая фаза протекает субклинически и часто лица с серологической картиной перенесенного острого гепатита B не вспоминают о том, что когда-то страдали этим заболеванием.
По клиническим и прежде всего гистологическим показателям хронический активный гепатит отличается от хронического персистирующего гепатита В; однако между этими формами болезни не существует характерных серологических различий, хотя, как правило, в первом случае чаще выявляется HBsAg, выше концентрация HBsAg и значения трансаминаз, анти-НВс определяются в более высоких титрах и принадлежат к классу IgM. Иногда при хроническом активном гепатите HBsAg не определяется в сыворотке и об этиологическом значении HBV у таких больных можно догадываться только по выявлению анти-НВс. В отдельных случаях хронический активный гепатит переходит в цирроз или гепатоцеллюлярную карциному. Эти клинические формы HBV-инфекции имеют приблизительно такую же серологическую картину, как и хронический активный гепатит, но выраженность всех иммунологических реакций неспецифически снижена. В 2/3 случаев при хроническом гепатите В (включая цирроз печени) начальная острая фаза инфекции остается незамеченной, так что только иммунологические признаки (особенно анти-НВс) позволяют рассматривать эти случаи заболевания как исход острого вирусного гепатита. Серологические данные свидетельствуют, что практически все случаи хронического персистирующего и большинство случаев хронического активного гепатита являются результатом вирусной инфекции. Хронический активный гепатит невирусной этиологии протекает с иной клинической картиной. Частота развития хронического гепатита (включая цирроз) коррелирует с распространенностью HBV-инфекции: заболевание чаще встречается там, где HBV-инфекция является эндемичной, как, например, на Дальнем Востоке.
Необходимо упомянуть о серологической картине при бессимптомном носительстве HBsAg, которое выявляется у 0,1% населения в Центральной Европе. При носительстве HBsAg выявляются анти-НВс (IgG класса) и иногда анти-НВе. Эти маркеры в принципе указывают на отсутствие прогрессирования процесса. Частицы Дейна не обнаруживаются. Известно, что кровь бессимптомных носителей может обусловливать развитие трансфузионного гепатита и что у 1/3 из них выявляются гистологические признаки этого заболевания или легкое повышение активности трансаминаз. В Центральной Европе наряду с 0,1% населения, являющегося HBsAg-позитивным, у 4-8% обнаруживаются признаки перенесенной инфекции - анти-HBs и/или анти-НВс. У привитых в плазме выявляют, разумеется, только один маркер - анти-HBs.
Особенное течение HBV-инфекция приобретает у лиц с иммуносупрессией, например у наркоманов, больных на гемодиализе или при трансплантациях, а также в случаях развития злокачественных гемопатий или лимфопролиферативных заболеваний. Речь идет о длительно текущем гепатите с множественными обострениями и ремиссиями, изменяющейся гистологической картиной и относительно умеренной активностью. Предполагают, что причина развития данного состояния в снижении клеточного иммунитета. HBV-инфекция относительно часто передается в этих группах через кровь в результате обмена иглами или трансфузий крови.
Другие группы риска составляют гомосексуалисты, больные гемофилией, получающие факторы крови VIII и IX, умственно отсталые больные в медицинских учреждениях (особенно с трисомией 21, иммунная защита которых ослаблена). К группам риска относятся также медицинские работники и врачи, контактирующие с человеческой кровью. В Европе «сывороточный гепатит» в настоящее время благодаря применению разовых игл и материалов практически исчез и в основном регистрируется в упомянутых группах риска; спорадические случаи гепатита В у лиц, не принадлежащих к группам риска, отмечаются редко. В других частях света, особенно на Дальнем Востоке, HBV-инфекция не ограничивается группами риска; около 10% лиц в популяции этого региона - носители HBsAg.
Хотя переход из острого в хронический гепатит объясняют неудовлетворительным Т-клеточным иммунным ответом к HBsAg, все еще не ясно, в каких случаях хроническое повреждение печеночных клеток будет «персистирующим», а в каких - «активным», т. е. протекает с воспалительной инфильтрацией и разрушением септ. Специфический Т-клеточный иммунный ответ по отношению к HBsAg при хроническом активном гепатите выражен несколько слабее, чем при хроническом персистирующем, хотя это различие не является достаточным для того, чтобы объяснить существенные гистологические и прогностические различия между двумя формами заболевания.
Хотя у некоторых из HDV-суперинфицированных лиц (бессимптомное HBsAg-носители) гепатит протекает без осложнений и вирус может элиминироваться, у большинства из них развивается хронический активный гепатит. При ретроспективном серологическом исследовании HDV-маркеры (антиген и антитела) определялись в образцах сыворотки HBV-инфицированных больных с хроническим активным гепатитом чаще, чем при доброкачественном течении. Было высказано предположение, что HDV-инфекция играет, возможно, определенную роль в развитии хронического активного гепатита. В целом HDV-инфекция ухудшает прогноз заболевания.
Существуют также случаи хронического активного гепатита В без признаков HDV-инфекции; у таких лиц причины развития этого заболевания остаются неясными. Другие неизвестные до сих пор коинфекции могут, возможно, иметь дополнительное значение. Кроме того, известны гипотезы о наличии аутоиммунного механизма при возникновении перекрестных реакций между HBV и печеночными антигенами, а также о специфической недостаточности продукции антител к npe-S2 антигену.
Лечение гепатита . Лечение острых гепатитов, будь то гепатит А или В не разработано. Не существует и эффективного лечения вирусных хронических гепатитов. Клинические исследования позволяют сделать заключение, что применение антивирусных препаратов, в особенности интерферона, при хронической активной форме обоснованно, стероиды и иммуносупрессивная терапия при этом противопоказаны. Отсутствие действенных медикаментов не является проблемой в случае доброкачественного гепатита А. В случае HBV-инфекции этот факт подчеркивает значение профилактических мероприятий, особенно активной иммунизации. При профилактике ни А, ни В инфекции может быть рекомендована разумная сдержанность по отношению к трансфузиям крови.
Инфекция HBV – одна из самых распространённых вирусных инфекций человека. По данным ВОЗ, более 25% населения уже были инфицированы HBV (обнаружение антител к НВsAg) и от 5 до 10% являются его носителями (по HBsAg). HBV высокоустойчив к внешним воздействиям и сохраняет инфекциозность при: комнатной температуре – 3 месяца, в холодильнике – 6 месяцев, в замороженном виде и в высушенной плазме – 15-25 лет, при автоклавировании – в течение 30 мин и при стерилизации сухим паром – 60 минут.
Основным резервуаром вируса в природе являются здоровые вирусоносители (5% населения) и больные хроническим гепатитом (5%), у которых показатель инфицированности окружающих составляет 25-50% в зависимости от активности процесса. Вирус часто проникает через неповреждённые слизистые и небольшие повреждения кожи и момент заражения остаётся неизвестным.
1. Ведущее значение в распространении HBV имеют парентеральные пути заражения:
А) оперативные вмешательства, чаще малые (стоматологические), инъекционная терапия, наркоманы, акупунктуры, экстракорпоральные методы очищения крови;
Б) эндоскопические исследования;
В) медицинские работники хирургического профиля, имеющие контакт с кровью и её компонентами;
Г) переливание крови и её компонентов (реже эритромассы), препаратов факторов свёртывания;
Д) бытовые процедуры – татуировки, проколы ушных мочек, пирсинг, маникюр, бритьё.
2. Большое значение имеют естественные пути передачи инфекции:
А) передача вируса половым путём является основной причиной инфицирования, наиболее частой в возрасте 16-25 лет, когда вероятна смена сексуальных партнёров;
Б) вертикальная передача вируса матерью-вирусоносительницей своему плоду во время родов (интранатальный период), редко трансплацентарное инфицирование, что диктует необходимость пассивно-активной иммунизации новорожденных от матерей с метками репликации вируса;
В) возможно инфицирование в постнатальный период с молоком и слюной, поэтому для диагностики вирусных заболеваний печени необходимо выявление меток инфицирования вирусом и заболеваний печени у родителей.
Выше перечисленное делает целесообразным вакцинацию всех новорожденных в постнатальный период вне зависимости от инфицирования матери.
Вирус гепатита В относится к группе гепаднвирусов, то есть гепатотропных ДНК содержащих вирусов. HBV состоит из поверхностного (HBs), ядерного (HBc) антигенов и.
Ядерный антиген (HBcAg) представляет собой главный белок нуклеокапсида и содержит две циркулярные нити ДНК, одна из которых неполная, поэтому HBV не способен к прямой репликации ДНК. При попадании в цитоплазму клетки вирусная ДНК достраивается вирусной ДНК-полимеразой (становится полной - двухцепочечной) и проникает в ядро, где транслируется под действием клеточной РНК-полимеразы с образованием полных РНК-копий генома. Они в свою очередь кодируют синтез ДНК и белка капсида в ядре, а гликопротеидов оболочки – в цитоплазме, то есть происходит репликация вирусов, которые покидают клетку.
Полная ДНК вируса содержит ген С, который кодирует синтез нуклеокапсида. Ген С имеет два локуса (промотора): собственно ген с, запускающий транскрипцию HBcAg и ген пре-с, кодирующий транскрипцию белка, превращающегося в HBeAg – сигнальный пептид. HBcAg, содержащий ДНК и ДНК-полимеразу, остаётся в основном в ядрах гепатоцитов вне хромосом (экстрахромосомно), где его можно обнаружить в поражённых клетках (биоптаты, лейкоциты) и покидает гепатоциты только в виде частиц Дейна – вирус HBV, поэтому в свободном состоянии он в крови не обнаруживается. HBeAg – сигнальный пептид – растворим, поступает в кровь и является количественным показателем репликации вируса. Помимо крови, HBeAg и HBV-ДНК выявляются в слюне, моче и семенной жидкости у мужчин. Однако, нередко обнаруживается мутация генома вируса с исчезновением гена пре-с, в связи с чем репликация вируса может продолжаться при прекращении продукции HBeAg, снижая информативность его отсутствия. Существует мнение, что HBe-отрицательные мутанты вызывают более агрессивное течение острого и хронического гепатитов и плохо поддаются лечению интерфероном.
Антитела к HBсAg (НВcAb) обнаруживаются приблизительно одновременно с цитолизом (его вызывают). НВcAb из класса иммуноглобулинов М свидетельствуют о репликации вирусов и длительное их сохранение (свыше 6 месяцев) предполагает хронизацию. НВcAb из класса иммуноглобулинов G могут сохраняться в течение многих лет после острого гепатита и у всех носителей, не свидетельствуя об активности процесса. HBeAb определяются в свободном состоянии после исчезновения НВeAg, что свидетельствует о прекращении репликации вируса и рассматривается как благоприятная иммунологическая динамика - обычно развивается длительная ремиссия хронического гепатита. HBeAb в составе иммунных комплексов играют большую роль в развитии васкулитов (гломерулонефрит, узелковый периартериит).
Внешняя оболочка вируса обозначается как НВsAg. Синтез белков оболочки вируса кодируется геном S, в котором выделяют 3 локуса: собственно ген S, при трансляции которого образуется главный белок оболочки и гены пре-S 1 и 2, кодирующих синтез прикрепительных белков. Прикрепительные белки (S1 и S2) участвуют в распознавании вируса рецепторами гепатоцитов и адгезии его на их поверхности. Они стимулируют образование вирусонейтрализующих антител (НВsAb), что используется при вакцинации. НВsAg определяется в плазме гепатоцитов, а также практически во всех биологических жидкостях: крови, сперме, вагинальной секрете, моче, слюне, желчи, грудном молоке, асцитической, синовиальной и спинномозговой жидкости. Он выявляется при остром гепатите и исчезает при реконвалесценции (через 3-6 месяцев). Сохранение его свыше 6 месяцев предполагает хронизацию процесса. У небольшой части он остаётся на долгие годы (фаза интеграции).
Антитела к HBsAg (HBsAb) обнаруживаются после исчезновения HBsAg, обычно сохраняются до конца жизни и имеют протективное действие, блокируя прикрепительный белок и проникновение вируса в клетку при реинфекции. HBsAb выявляются у 20-25% населения, свидетельствуя о перенесённом контакте с вирусом, реконвалесценции и стойком иммунитете, что не требует вакцинации. В настоящее время HBsAb появляются после вакцинации (рекомбинантный НВsAg), обеспечивая посредством блокады прикрепительного белка оболочки вируса поствакционный иммунитет, более стойкий у детей и менее – у взрослых (5-10 лет). Уровень HBsAb в этом случае определяет сроки ревакцинации. При изолированном НВsAg-носительстве (стадия интеграции) сферические и нитевидные частицы, состоящие только из белков внешней оболочки, содержат значительно меньше прикрепительных белков, чем в полных вирионах, поэтому в этом случае возможно выявление низкоаффинных антител к НВsAg в небольшом титре, не обладающих протективным действием и не препятствующих реинфекции и рецидиву.
При заражении НВV выделяют два типа процесса – репликация (размножение) и интеграция (встраивание) фрагментов ДНК вируса в геном клетки.
1. Репликация . При попадании HBV в кровь он прикрепляется к оболочке гепатоцита посредством прикрепительного белка (пре-S), что обуславливает его проникновение в клетку. Происходит трансляция с локусов ДНК вируса генов C и S на транскрипционную РНК с последующими репликацией вирусного генома и синтезом вирусных белков посредством клеточных ферментов. В ядрах гепатоцитов происходит репликация ДНК вируса, синтез HBcAg, а в цитоплазме – НВsAg. Установлен факт репликации вируса и вне печени: в клетках крови (лимфоциты, макрофаги), костном мозге, лимфоузлах, селезёнке, эндотелии, экзокринных (слюнные, молочные, поджелудочная) и эндокринных железах, почках, коже, сперматозоидах. Следовательно, доказательством репликации вируса, обуславливающей цитолиз, является обнаружение в крови HBV-ДНК (количественный метод), НВeAg (качественный метод), НВcAb из иммуноглобулинов М или НВcAg и HBV-ДНК в биоптатах и лейкоцитах.
2. Интегративный процесс лежит в основе антигеноносительства и персистенции вирусной инфекции при ХГ. Интеграции вируса всегда предшествует репликация. Судить о наличии интеграции при репликации с присутствием всех антигенных детерминант не представляется возможным. Она устанавливается лишь при прекращении репликации вируса и связанного с ней цитолиза. Интеграция обнаруживается чаще при длительной виремии, в связи с чем её вероятность увеличивается при затяжном течении (10% ежегодно). При интеграции происходит встраивание фрагментов ДНК вируса в ДНК клетки - такое состояние обозначается как хромосомное или интегральное. Фрагменты ДНК вируса (гены C и S) встраиваются в различные участки ДНК клетки дискретно. В этом случае полных форм вируса, способных к размножению (цитолизу) нет, но клеточная ДНК включает в себя информацию о репродукции структур вируса. То есть в стадии интеграции сохраняется риск инфицирования, когда интегрированная ДНК, попав вместе с клетками (лейкоциты, трансплантат) в организм реципиента, служит программой его репродукции.
Интеграция может быть представлена в двух вариантах:
А) трансляционный тип – происходит растормаживание (экспрессия) лишь встроенного гена S с его считкой (трансляций) на транскрипционную РНК и изолированным синтезом в цитоплазме клетки НВsAg с последующим поступлением его в кровь – НВs-антигенемия в виде сферических и нитевидных частиц. Возможно выявление в малом титре низкоаффинных антител к НВsAg, не обладающих протективным действием.
Б) нетрансляционный тип, когда в ДНК гепатоцитов не происходит экспрессии, а следовательно и трансляции интегрированных вирусных генов и в крови отсутствуют маркёры вируса, но в клеточном геноме обнаруживается интегрированная вирусная ДНК. Это определяет возможность инфицирования при переливании крови, её производных и при пересадке органов с отсутствием НВsAg.
Частотная характеристика перехода острого HBV–гепатита в хронический зависит от возраста. У новорожденных инфицирование чаще протекает бессимптомно, но и часто переходит в вирусоносительство (HBs-антигенемия) или в хроническую форму. У молодых, как правило, наблюдается развёрнутая клиническая картина (защитный цитолиз при нормальном иммунитете) с редким переходом в хронический. У взрослых и пожилых хронизация чаще. Особенно ухудшают прогноз сопутствующие заболевания и интоксикации (этанол, наркотики). Таким образом, хронический HBV–гепатит чаще развивается без указаний на острый. Реже – после острого.
Полная элиминация вируса (выздоровление) с исчезновением НВsAg и последующим иммунитетом (HBsAb) происходит у 85-90% инфицированных. HBs-антигенемия сохраняется в течение нескольких лет у 5%, а у 5-10% инфицированных – пожизненно. Дефекты гуморального (снижение продукции интерферона) и клеточного (ингибиция ответа лимфоцитов на интерферон) иммунитета ответственны на неспособность организма быстро элиминировать вирус, что способствует его интеграции и переходу острого гепатита в вирусоносительство или хронический. Существенную роль в хронизации гепатита B и его обострениях играют мутантные формы HBV, которые позволяют избегать иммунного надзора организма. Так появление HBe-отрицательных мутантов в течение 2 лет отмечено у 40% больных ХГ.
Антигеноносительство чаще наблюдается при бессимптомных и субклинических формах острого HBV–гепатита, так как меньшая выраженность иммунной защиты определяет и меньший защитный цитолиз: грудные дети, перенесшие HBV-инфекцию становятся HBs-носителями в 90% случаев, дети - в 20-30% и взрослые – в 5-10% случаев.
Большая частота бессимптомного HBs-носительства (более 1-2% населения Европы, США, 5% - в России и до 20% в Азии, Африке, Латинской Америке) требует разграничения так называемого здорового носительства от персистирующей HBV-инфекции – хронического гепатита в стадии ремиссии. К здоровым HBs-носителям ошибочно относят до 40% больных с хроническим гепатитом, поэтому все HBs-положительные, а также лица с цитолитическим и иммунновоспалительным синдромами должны подвергаться детальному обследованию, включая пункционную биопсию печени. Выявление иммунных (лимфо-макрофагальных) портальных и перипортальных инфильтратов свидетельствует о хронизации гепатита. У «здоровых» HBs-носителей в биоптатах печени могут выявляться изменения от минимальных до цирроза печени. Так у доноров с HBs-антигенемией в 2% случаев обнаружены морфологические признаки хронического гепатита.
Предполагается периодическая сменяемость фаз интеграции (ремиссии) и репликации (рецидива). В ряде случаев можно всё-таки выявить репликацию вируса в клетке современными высокочувствительными методами. Кроме того, понятие здорового вирусоносительства условно. Переход фазы интеграции в репликацию происходит вследствие активации (экспрессии) генома клетки при регенераторных процессах, сопровождающих повреждения печени при экзогенных (этанол) и эндогенных интоксикациях, а также при приёме гепатопротекторов. В этом случае дополнительно к экспрессии гена S происходит растормаживание всех локусов ДНК вируса, включая ген С, их трансляция на РНК с внутриклеточной репродукцией вирусных частиц и переходом в стадию репликации – рецидива. Возможна спонтанная сменяемость фаз. Аналогичной программой репродукции вируса в организме реципиента служит его ДНК, интегрированная в клетки крови или трансплантата донора. Переход интеграции в репликацию сопровождается цитолизом (как при остром HBV-гепатите).
Внепечёночные проявления HBV-инфекции, по-видимому, имеют иммуннокомплексную природу. Отложения ЦИК, состоящие из вирусных антигенов, антител к ним и комплемента выявляются в клубочках (гломерулонефрит), в мелких и средних артериях (узелковый периартериит). Кроме того, распространённое вирусное инфицирование ведёт к перемещению в поражённые органы лимфо-макрофагальных элементов с формированием лимфо-, плазмо-, моно-, гистиоцитарных инфильтратов, отражающих генерализацию иммунно-воспалительного синдрома. Реже встречается доказанное индуцирование вирусами гепатита B аутоагрессивных реакций вследствие инфицирования ими лимфо-макрофагальной системы (в частности Т-супрессоров) с приобретённым снижением толерантности к аутоантигенам.
Существенную роль в хронизации гепатита В и его обострениях играют мутантные формы HBV, которые позволяют избегать иммунного надзора организма. Так появление HBe-отрицательных мутантов в течение 2 лет обнаружено у 40% больных хроническим гепатитом.
Наличие вирусоносительства, даже в стадии интеграции, повышает риск развития гепатоцеллюлярной карциномы (первичного рака печени) в 5-10 раз.
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Клинические протоколы МЗ РК - 2015
Хронический вирусный гепатит b без дельта-агента (B18.1), Хронический вирусный гепатит b с дельта-агентом (B18.0)
Гастроэнтерология
Общая информация
Краткое описание
Экспертным советом
РГП на ПХВ «Республиканский центр развития здравоохранения»
Министерства здравоохранения и социального развития Республики Казахстан
Протокол № 10
Хронический гепатит В
- некровоспалительное заболевание печени, вызванное вирусом гепатита В, характеризующееся наличием определяемого поверхностного антигена вируса гепатита В (HBsAg) в крови или сыворотке длительностью более 6 месяцев .
I. ВВОДНАЯ ЧАСТЬ
Название протокола:
Хронический вирусный гепатит В у взрослых.
Код протокола:
Код(ы) МКБ-10:
B 18.1 - Хронический гепатит В без дельта агента;
B 18.0 - Хронический гепатит В с дельта агентом.
Сокращения, используемые в протоколе:
АЛТ - аланинаминотрансфераза
AMA - антимитохондриальные антитела
АН - аналоги нуклеозидов/нуклеотидов
АСТ - аспартатаминотрансфераза
АФП - альфа-фетопротеин
ВГВ - вирусный гепатит B
ВГН - верхняя граница нормы
ВГС - вирусный гепатит С вирусный гепатит С
ВГD - вирусный гепатит D
ВИЧ - вирус иммунодефицита человека
ВРВ - варикозно-расширенные вены
ГТП - гамма-глутамилтранспептидаза
ГЦК - гепатоцеллюлярная карцинома
ДНК - дезоксирибонуклеиновая кислота
ИМТ - индекс массы тела
ИАГ - индекс гистологической активности
ИСТ - иммуносупресивная терапия
ИФА - иммуноферментный анализ
ИХА - иммунохимический анализ
МЕ - международные единицы
Мл - миллилитр
МНО - международное нормализованное отношение
МРТ - магнитно-резонансная томография
ОАК - общий анализ крови
ОАМ - общий анализ мочи
ОБП - органы брюшной полости
ПБП - пункционная биопсия печени
ПВ - протромбиновое время
ПВТ - противовирусная терапия
ПЕГ-ИНФ - пегилированный интерферон
ПЦР - полимеразная цепная реакция
РК - Республика Казахстан
РНК - рибонуклеиновая кислота
СОЭ - скорость оседания эритроцитов
ТП - трансплантация печени
ТТГ - тиреотропный гормон
УЗИ - ультразвуковое исследование
УЗДГ - ультразвуковая допплерография
ХГ - хронический гепатит
ХГВ - хронический гепатит В
ХГD - хронический гепатит D
ХГС - хронический гепатит C
ЦП - цирроз печени
ЩФ - щелочная фосфатаза
ЭГДС - эзофагогастродуоденоскопия
ЭКГ - электрокардиограмма
УД - уровень доказательности
ANA - антинуклеарные антитела
Anti-HBc /IgM - антитела к HBcAg класса М
Anti-Hbe - антитела к HBeAg
Anti-HBs - антитела к HBsAg
Anti-HCV - антитела к вирусу гепатита C
Anti-HDV - антитела к вирусу гепатита D
Anti-HDV IgM - антитела к вирусу гепатита D класса М
Anti-HIV - антитела к ВИЧ
Anti-НВс /IgG - антитела к HBcAg класса G
APRI - индекс соотношения АСТ к числу тромбоцитов
ETV - энтакавир
HAV - вирус гепатита А
HBcAg - сердцевинный или ядерный антиген гепатита В
HBeAg - внутренний антиген вируса гепатита В
HBsAg - поверхностный антиген вируса гепатита В
HBV - вирус гепатита В
HBV ДНК - ДНК ВГВ
HCV - вирус гепатита С
HCV РНК - РНК ВГС
HDV - вирус гепатита D
HDV РНК - РНК ВГD
IgG - иммуноглобулины класса G
IQR - интерквартальный коэффициент
IU - международные единицы
NICE - National Institute for Health and Care Excellence
F - фиброз
FDA - Food and Drug Administration - Управление по санитарному надзору за качеством пищевых продуктов и медикаментов
LAM - ламивудин
LdT - телбивудин
LBx - биопсия печени
MELD - Model for End-stage Liver Disease
Log - логарифм
Дата разработки протокола
: 2015 год.
Пользователи протокола
: гастроэнтерологи, инфекционисты, хирурги, трансплантологи, онкологи, нефрологи, терапевты, врачи общей практики.
Оценка на степень доказательности приводимых рекомендаций.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
| GPP | Наилучшая фармацевтическая практика |
Классификация
Клиническая классификация
Общепринятая классификация отсутствует.
При постановке диагноза необходимо указать вирусологический статус (HBeAg-позитивный или HBeAg-негативный статус, вирусную нагрузку, наличие дельта-агента), активность (биохимическую и/или гистологическую), а также стадию заболевания (по данным непрямой эластографии или морфологического исследования) .
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Перечень основных и дополнительных диагностических мероприятий
Основные (обязательные) диагностические обследования, проводимые на амбулаторном уровне
(исследования, необходимые для всех пациентов с ВГВ):
1. ОАК с подсчетом тромбоцитов;
2. Биохимический профиль: АЛТ, АСТ, щелочная фосфатаза, общий билирубин, прямой билирубин, непрямой билирубин, ГГТП, альбумин, креатинин.
3. Коагулограма: МНО или ПВ;
4. Серологические исследования (методом ИХА/ИФА): HBsAg (качественный тест), HBeAg, anti-HBs, anti-HBe, anti-HBc /IgM, anti-НВс /IgG, anti-HDV IgM, anti-HDV total, anti-HCV, anti-HIV.
6. Молекулярная диагностика на основе полимеразной цепной реакции:
7. Ультразвуковое исследование органов брюшной полости (УЗИ ОБП): печень, селезенка, желчный пузырь, поджелудочной железы;
8. Непрямая эластография.
Дополнительные диагностические обследования, проводимые на амбулаторном уровне:
Биохимический профиль:мочевина, калий, натрий, гамма-глобулины, общий холестерин, триглицериды, глюкоза, сывороточное железо, ферритин, аммиак;
Церулоплазмин;
Тест на беременность;
Осмотр глазного дна.
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию : согласно внутреннему регламенту стационара с учетом действующего приказа уполномоченного органа в области здравоохранения.
Основные (обязательные) диагностические обследования, проводимые на стационарном уровне:
ОАК с подсчетом тромбоцитов;
Биохимический профиль: АЛТ, АСТ, щелочная фосфотаза, общий билирубин, прямой билирубин, ГГТП, альбумин, креатинин.
Коагулограмма: МНО или ПВ;
Серологические исследования (методом ИХА/ИФА):HBsAg (качественный тест), HBeAg, anti-HBs, anti-HBe, anti-HBc /IgM, anti-НВс /IgG, anti-HDV IgM, anti-HDV total, anti-HCV, anti-HIV.
Молекулярная диагностика на основе полимеразной цепной реакции:
Определение HBV-ДНК (качественный тест);
При положительном результате качественного теста HBV-ДНК - количественное определение HBV-ДНК;
При наличии anti-HDV - определение HDV-РНК (качественный тест)
При положительном результате качественного теста HDV-РНК - количественное определение HDV-РНК;
Ультразвуковое исследование органов брюшной полости (УЗИ ОБП): печень, селезенка, желчный пузырь, поджелудочной железы;
Непрямая эластография.
Дополнительные диагностические обследования, проводимые на стационарном уровне:
Биохимический профиль: мочевина, калий, натрий, гамма-глобулины, общий холестерин, триглицериды, глюкоза, сывороточное железо, ферритин, аммиак;
HBsAg (количественный тест);
Церулоплазмин;
Функциональные пробы щитовидной железы: ТТГ, Т4 свободный, Ат к ТПО;
Тест на беременность;
УЗДГ сосудов печени и селезенки;
КТ органов брюшной полости (при подозрении на объёмные образования и тромбозы - с в/в контрастированием);
МРТ органов брюшной полости (при подозрении на объёмные образования и тромбозы - с в/в контрастированием;)
Осмотр глазного дна.
Диагностические мероприятия, проводимые на этапе скорой неотложной помощи: нет.
Диагностические критерии постановки диагноза
Жалобы и анамнез
Первоначальная оценка пациентов с хроническим гепатитом В должна включать тщательный сбор жалоб, анамнеза и физикальное обследование, с акцентом на факторы риска, таких как ко-инфекции, употребление алкоголя, семейная история инфекции ВГВ и рака печени (УД - А).
Жалобы
Хронический гепатит В часто протекает бессимптомно на ранних стадиях заболевания; могут быть недомогание; усталость.
На более поздних стадиях появляются симптомы, связанные с портальной гипертензией и терминальной стадии заболевания печени (желтуха, энцефалопатия, асцит, кровотечение из варикозных узлов и т.д.).
Хронический гепатит В может быть ассоциирован с внепеченочными проявлениями, такими как: апластическая анемия, папулезный акродерматит, синдром Шегрена, кожный васкулит, узелковый полиартериит, полиартралгии, миалгии, миокардит, гломерулонефрит, фиброзирующий альвеолит, криоглобулинемия и др.
Анамнез
Необходимо уточнить следующие факторы риска заражения HBV-инфекцией :
Иммиграция из эндемичных стран по HBV-инфекции;
Наличие у родителей HBV-инфекции;
Контакт с HBV-носителем;
Сексуальный контакт с HBV-носителем, HIV;
Большое количество сексуальных партнеров;
Мужчины, имеющие половые контакты с мужчинами;
Использование в прошлом или в данный момент внутривенных наркотиков;
Пребывание в местах заключениях;
Проведение диализа;
Переливания крови, оперативные вмешательства, трансплантация органов и тканей.
Физикальное обследование
При физикальном осмотре можно не обнаружить никаких специфических признаков или выявить стигмы хронического заболевания печени: желтуху гепатомегалию, спленомегалию (10%), пальмарную эритему, сосудистые звездочки, полиартрит. При развитии цирроза печени отмечаются симптомы, обусловленные дисфункцией печени и портальной гипертензией.
Лабораторные исследования :
. ОАК с подсчетом тромбоцитов (УД - А) проводится в целях диагностики гиперспленизма (цитопении), выявления анемии (различно этиологии), выявления показателей системного воспалительного ответа, а также определения противопоказаний и мониторинга побочных явлений ПВТ.
. Биохимический анализ крови
необходим для определения следующих биохимических синдромов (УД - А):
− Синдром цитолиза: повышение активности АЛТ, АСТ. По уровню АЛТ выставляется степень биохимической активности (Таблица№2).
Таблица 2
. Степень биохимической активности
− Синдром холестаза: повышение активности ЩФ, ГТП, уровней прямого билирубина, холестерина;
− Синдром печеночно-клеточной недостаточности: гипоальбуминемия, увеличение МНО, ПВ.
− Синдром шунтирования: повышение уровня аммиака.
− Синдром иммунного воспаления: ускорение СОЭ, гипергамма-глобулинемия, наличие аутоантител.
Кроме того, по биохимическому анализу крови проводят оценку тяжести заболевания печени:
− уровень АЛТ, как правило, выше, чем уровни АСТ, но соотношение может меняться при прогрессирующем фиброзе и циррозе;
− характерные признаки цирроза — прогрессирующее снижение уровня альбумина плазмы, удлинение протромбинового времени, снижением числа тромбоцитов.
. Альфа-фетопротеин (АФП) используется в качестве скринингового теста ГЦК . (УД - А).
. Показатели сывороточного железа и ферритина
необходимы в целях исключения гемохроматоза и синдрома вторичной перегрузки железом.
. Серологическая диагностика
проводится с использованием иммунохемилюминисцентного анализа (ИХА), при отсутствии ИХА - иммуноферментного анализа (ИФА); вирусологическая диагностика HBV-инфекции (в целях определения репликации вируса) проводится на основе полимеразной цепной реакции (качественный тест, при положительном результате - количественный) с использованием автоматизированных систем закрытого типа в режиме реального времени с нижним лимитом определения 6-10 МЕ/мл.
На основе серологической и вирусологической диагностики определяется фаза HBV-инфекции .
В естественном течении хронического вирусного гепатита В выделяют несколько фаз (Таблица№3, Рисунок №1):
− Иммунотолерантная
− Иммунореактивная (иммунного клиренса или HBeAg-позитивный ХГВ)
− Неактивное носительство HBsAg (низкорепликативная)
− HBeAg-негативный ХГВ (реактивации)
− HBsAg-негативная (паст-инфекция HBV, оккультный ХГВ)
Установление фазы ХГВ важно для определения прогноза заболевания и показаний к противовирусной терапии.
Таблица №3
. Фазы хронического вирусного гепатита В.
| Фазы | HBsAg | Anti-HBs | HBeAg | Anti-HBe | HBV DNA | АЛТ | Гистология | |
| 1. Иммунотолерантная (чаще и длиннее при перинатальном заражении) | + | -- | + | N | N | |||
| 2. Иммунореактивная (HBeAg-позитивный (недели-годы) | + | -- | + | |||||
| 3. Неактивное носительство HBsAg |
<1000 МЕ/мл |
-- | -- | + |
+/-- <2000 (иногда до 20000) МЕ/мл |
N | N | |
| 4. HBeAg-негативный ХГВ | + | -- | -- | + | Активный гепатит, прогрессирующий фиброз | |||
| 5. HBsAg-негативная | Паст-инфекция HBV | -- | +/-- | -- | + | -- | N | N |
| Оккультный ХГВ | -- | + | -- | + | В печени: +; в сыворотке: +/-- (<200 МЕ/мл) | N/ | Гепатит, фиброз | |
Рисунок№1 . Диагностика и естественное течение ХГВ
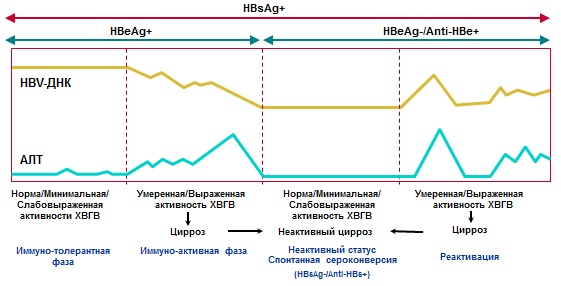
Необходимо также проводить поиск других возможных причин хронического заболевания печени, включая ко-инфекцию HDV (определение anti-HDV строго обязательно у всех пациентов с HBV-инфекцией), HCV и/или ВИЧ. У пациентов с хронической HBV-инфекцией требуется также определять антитела к вирусу гепатита А (анти-HAV), а при их отсутствии следует рекомендовать вакцинацию против HAV-инфекции.
Инструментальные исследования
УЗИ
позволяет оценить структуру печени, признаки фиброза, перехода цирроза печени (неровный край, нодулярная структура, атрофия правой доли, наличия асцита, расширение и тромбоз сосудов печени и селезенки, наличие шунтов, спленомегалия и другие признаки портальной гипертензии), а также наличие объемных образований (ГЦК и др.) (УД - А). Для уточнения изменений кровотока целесообразно использование УЗДГ.
Другие лучевые методы исследования (КТ или МРТ с внутривенным контрастным усилением) используются для верификации объемных образований и тромбозов .
Эндоскопические исследования необходимы для диагностики ВРВ пищевода и желудка, портальной гастропатии, других сопутствующих поражений слизистой оболочки гастродуоденальной зоны, а также выявления расширения геморроидальных вен.
Диагностика стадии фиброза проводится с помощью пункционной биопсии печени и неинвазивных методик
(НЭ, биомаркеров: исчисляемых индексов и зарегистрированных коммерческих наборов).
Пункционная биопсия печени (ПБП) для определения степени воспаления, некроза и фиброза рекомендуется пациентам, т. к. сведения о морфологических изменениях печени могут оказаться полезными при принятии решения о начале терапии (УД - А). Биопсия также может помочь выявить другие возможные причины поражения печени, такие как стеатоз, стеатогепатит, атоиммуный гепатит и т.д. Несмотря на то, что биопсия печени - инвазивная процедура, риск тяжелых осложнений крайне низок (1:4000-10 000) . Очень важно, чтобы при пункционной биопсии размер получаемого образца был достаточным для точного суждения о степени поражения печени и выраженности фиброза.
Пункционная биопсия печени для уточнения стадии фиброза может быть рекомендована пациентам с результатами НЭ в области серой зоны (от 6 до 10 кРа).
В ряде случаев, проведение биопсии целесообразно при результатах НЭ меньше 6 кПа у пациентов в возрасте младше 30 лет с уровнем ДНК HBV выше 2000 МЕ/мл и повышенным уровнем АЛТ (≥ 30 МЕ/л у мужчин и ≥ 19 МЕ/л у женщин) по результатам 2 анализов, проведённых с интервалом в 3 месяца.
Биопсия обычно не требуется у больных с клиническими признаками цирроза печени, а также у пациентов, которым терапия показана независимо от степени активности процесса и стадии фиброза. Проведение пункционной биопсии также не рекомендуется пациентам с результатами транзиторной эластографии менее 6кПа, нормальной активностью АЛТ и уровнем HBV-ДНК < 2000 МЕ/мл, так как вероятность серьёзного поражения печении и необходимости проведения противовирусной терапии у таких пациентов крайне мала.
Оценка результатов ПБП проводится с применением полуколичественных шкал описания степени некровоспалительных изменений и стадии фиброза ткани печени (см. Таблицы 4 и 5).
Таблица 4
. Морфологическая диагностика степени некровоспалительной активности гепатита
| Диагноз гистологический | METAVIR | Knodell (IV) | Ishak |
| ХГ минимальной активности | А1 | 0-3 | 0-3 |
| ХГ слабовыраженной активности | А1 | 4-5 | 4-6 |
| ХГ умеренной активности | А2 | 6-9 | 7-9 |
| ХГ выраженной активности | А3 | 10-12 | 10-15 |
| ХГ выраженной активности с мостовидными некрозами | А3 | 13-18 | 16-18 |
Таблица 5 . Морфологическая диагностика стадии заболевания печени (выраженности фиброза)
| Стадия фиброза |
METAVIR* |
Knodell (IV) | Ishak |
| Нет фиброза | F0 | 0 | 0 |
| Портальный фиброз нескольких портальных трактов | F1 | 1 | 1 |
| Портальный фиброз большинства портальных трактов | F1 | 1 | 2 |
| Несколько мостовидных фиброзных септ | F2 | 3 | 3 |
| Много мостовидных фиброзных септ | F3 | 3 | 4 |
| Неполный цирроз | F4 | 4 | 5 |
| Полностью сформировавшийся цирроз | F4 | 4 | 6 |
*Для определения стадии заболевания печени чаще применяется шкала METAVIR
Непрямая эластография (НЭ) имеет большее клиническое значение, чем сывороточные биомаркеры фиброза печени . Позволяет судить об изменении эластических свойств печени на основании отраженных вибрационных импульсов и последующего их компьютерного анализа. Интерпретация результатов непрямой эластографии представлена в Таблице №6. Значение от <5-6 кПа часто указывает на отсутствие или минимальной степени фиброз печени , а > 12-14 кПа часто указывает на цирроз печени. В сомнительных случаях, если это повлияет на тактику ведения больного, рекомендуется биопсия печени (схема №1). Среди больных хроническим гепатитом В с повышением уровня АЛТ, интерпретация данных НЭ должны проводиться с осторожностью, так как данные могут быть завышенными, даже в течении 3 - 6 месяцев после нормализации АЛТ .
Таблица 6 . Интерпретация результатов непрямой эластографии
Интерпретация результатов эластометрии затруднена в случаях (УД - А):
Избыточного веса (ИМТ>35 кг/м2)
Выраженного стеатоза печени
Высокой биохимической активности (АЛТ/АСТ выше верхнего лимита нормы в 3 и более раз)
Критерии успешного результата исследования:
Интерквартильный коэффициент (IQR) - не более 30% показателя эластичности.
Не менее 10 достоверных измерений в одной точке исследования
Не менее 60% успешных измерений.
Биомаркеры включают:
Индексы фиброза. Неинвазивные маркеры фиброза печени могут дать более развернутую оценку поражения печени . Эти методы более безопасные и дешевле, чем биопсия печени. Тест APRI (УД - А) использует только два параметра: АСТ и количество тромбоцитов .
Формула расчета
: APRI = * (AST/ULN) x 100) / platelet count (109/L)
0,3 - 0,5 исключают значимый фиброз и цирроз
>1,5 указывают на клинически значимый фиброз
Электронный калькулятор : www.hepatitisc.uw.edu/page/clinical-calculators/apri
Схема №1

Показания для консультации узких специалистов:
Консультация офтальмолога состояние глазного дна) - до и во время ПВТ;
Консультация психиатра - до, перед, во время при подозрении на депрессию;
Консультация дерматолога;
Консультация аллерголога - при наличии кожных/аллергических и аутоиммунных реакций;
Консультация онколога - при подозрении на ГЦК;
Консультация хирурга - трансплантолога - в случаях наличия показаний к ТП.
Дифференциальный диагноз
Дифференциальный диагноз с наиболее часто встречаемыми поражениями печени указаны в схеме №2 .
Схема №2

Медицинский туризм
Пройти лечение в Корее, Израиле, Германии, США
Медицинский туризм
Получить консультацию по медтуризму
Лечение
Цели лечения:
Замедление / прекращение прогрессирования заболевания печени;
Профилактика ЦП;
Профилактика ГЦК.
Тактика лечения
**
Достижение ответа на терапию. Выбор тактики ведения пациента с хроническим гепатитом В зависит от фазы вирусной инфекции и стадии заболевания печени: от динамического наблюдения и режимных (немедикаментозных) мероприятиях при неактивном носительстве HBsAg - до противовирусной терапии при активном гепатите.
Немедикаментозное лечение
Общие меры
:
Охранительный режим: избегать инсоляции, перегрева тела, в продвинутых стадиях заболевания и портальной гипертензии - ограничение физических нагрузок, облегчение режима работы (УД - В);
Барьерная контрацепция при половых контактах с не вакцинированными партнерами (УД - A);
Вакцинация против гепатита А (УД - A);
Вакцинация половых партнеров против гепатита В (УД -иA);
Индивидуальное пользование средствами личной гигиены (УД -A);
Минимизация факторов риска прогрессирования: исключение алкоголя, табака, марихуаны, гепатотоксичных лекарственных средств, включая биологически активные добавки, нормализация веса тела и т.д. (УД - A)
Медикаментозное лечение
Основу лечения хронического гепатита В составляет противовирусная терапия
(ПВТ) .
Общие показания к ПВТ :
HBV-ДНК ≥2 000 МЕ/мл
AЛТ ≥ верхней границы нормы (ВГН)
Тяжесть заболевания печени ≥ A2 и/или ≥ F2
Кроме того, учитываются возраст, общее состояние, семейный анамнез по ЦП, ГЦК, наличие внепеченочных проявлений и принадлежность пациентов к отдельным группам (Таблица №7).
Таблица №7
. Терапевтическая тактика в отдельных группах
|
Характеристика пациентов |
Тактика |
| Иммунотолерантная фаза |
HBeAg-позитивные пациенты < 30 лет с постоянно нормальной АЛТ высокой HBV DNA [обычно > 107 МЕ/мл], без признаков заболевания печени, без ГЦК и ЦП в семейном анамнезе не нуждаются в ПВТ Мониторинг каждые 3-6 месяцев У пациентов >30 лет и/или семейным анамнезом ГЦК - LBx и возможна ПВТ |
| HBeAg-негативные пациенты с нормальной АЛТ, HBV DNA 2000-20000 МЕ/мл |
Не нуждаются в срочной LBx и ПВТ Мониторинг АЛТ каждые 3 месяца HBV DNA - каждые 6-12 месяцев Через 3 года - мониторинг как при неактивном носительстве Непрямая эластография м.б. полезна |
| Активный ХГВ (HBeAg+/ HBeAg--) |
При АЛТ > 2ULN, HBV DNA > 20 000 МЕ/мл - ПВТ м.б. начата даже без LBx Непрямая эластография печени может быть полезна |
| Неактивные носители HBsAg |
В ПВТ не нуждаются Мониторинг каждые 6-12 месяцев |
| Компенсированный ЦП с HBV DNA (+) | . ПВТ в специализированный центрах даже при нормальной АЛТ |
| Декомпенсированный ЦП с HBV DNA (+) |
Неотложная ПВТ АН в специализированный центрах Определение показаний к ТП |
Для ПВТ ХГВ используются две стратегии :
. Длительное лечение аналогами нуклеотидов/нуклеозидов (данная стратегия направлена на поддержание ремиссии).
Перед проведением терапии пациенту должна быть предоставлена полная информация о терапии ПЕГ-ИФН и АН для совместного принятия решения о выборе метода лечения. Преимущества и недостатки стратегий ПВТ в зависимости от противовирусных агентов приведены в Таблице№8.
Таблица №8
. Преимущества и недостатки терапии на основе Пег-ИФН и АН
|
Препараты |
Преимущества | Недостатки |
| Пег-ИФН |
Отсутствие резистентности вируса Потенциальная возможность достижения иммунного контроля и устойчивого вирусологического ответа Высокая частота НВе- сероконверсии при 12-месячной терапии Вероятность клиренса / сероконверсии HBsAg у пациентов, достигших неопределяемый уровень HBV ДНК |
Риск побочных явлений Подкожное введение Противопоказания при декомпенсированном ЦП, аутоиммунных, психических и других сопутствующих заболеваниях, а также при беременности |
| АН |
Выраженный противовирусный эффект Хорошая переносимость Возможность применения при беременности (Тенофовир, Телбивудин) Пероральный прием |
Риск развития резистентности Неопределенная (во многих случаях - пожизненная) длительность терапии Отсутствие данных о безопасности длительного лечения |
Перечень противовирусных лекарственных средств, зарегистрированных в РК, представлен в Таблице №9.
Таблица№9
. Список лекарственных средств, одобренных для лечения ХГВ в РК и режим дозирования
|
МНН |
Фармакотерапевтическая группа | Форма выпуска | Режим дозирования |
| Пег-ИНФ альфа-2а |
Интерфероны Код АТХ L03АВ11 |
Раствор для инъекций 180 мкг/0,5 мл | 180 мкг еженедельно подкожно |
| Ламивудин |
Код ATС JO5AF05 |
100 мг в сутки внутрь | |
| Телбивудин |
Нуклеозиды - ингибиторы обратной транскриптазы Код АТX J05AF11 |
600 мг в сутки внутрь | |
| Тенофовир |
Нуклеозиды и нуклеотиды - ингибиторы обратной транскриптазы Код АТХ J05AF07 |
Таблетки, покрытые пленочной оболочкой, 300 мг | 300 мг в сутки внутрь |
| Энтекавир* |
Нуклеозиды-ингибиторы обратной транскриптазы Код АТX J05AF10 |
0,5 мг в сутки внутрь |
*Оригинальный препарат в РК не зарегистрирован
В качестве препаратов первой линии используются Пег-ИНФ альфа-2а или Тенофовир или Энтекавир, вызывающие наименьшую резистентность. Остальные АН можно применять для лечения ХГВ только при недоступности или невозможности использования АН первой линии.
В исследованиях было показано, что комбинация Пэг-ИФН и ламивудина не повышает достижение стойкого вирусологического или серологического ответа, комбинация с телбивудином характеризуется высоким риском тяжелой полинейропатии, а сведения об эффективности и безопасности комбинаций с тенофовиром и энтекавиром ограничены. Поэтому комбинации Пег-ИФН и АН не рекомендуются.
Основания для выбора режима терапии в отдельных клинических группах представлены в Таблице№10 .
Таблица №10
. Выбор режима терапии
| Предпочтительные препараты | |
| Пациенты молодого и среднего возраста без ЦП, женщины, желающие вылечиться перед беременностью | Пег-ИФН альфа-2а |
| Декомпенсированный ЦП | АН |
| Трансплантация печени | АН (Энтекавир, Тенофовир, Ламивудин) |
| Почечная недостаточность | Энтекавир |
| Беременность, женщины детородного возраста, планирующие беременность в ближайшее время | Тенофовир, Телбивудин |
| Паст-инфекция / оккультный гепатит до и вовремя проведения иммуносупрессивной терапии, химиотерапии | АН |
| ВГD | ПЕГ-ИФН альфа-2; в случае противопоказаний к ПЕГ-ИНФ альфа-2а или его неэффективности при наличии репликации HBV - АН |
| Коинфекция ВГС | ПЕГ-ИФН альфа-2 + RBV |
| ВИЧ-коинфекция | Тенофовир + Эмтрицитабин или Ламивудин |
Предикторы (факторы) ответа на ПВТ различиаются в зависимости от выбранной стратагии и противовирусного агента (Таблица №11). Учет этих факторов полезен для принятия решений о начале и продолжении противовирусной терапии .
Таблица №11 . Предикторы ответа на ПВТ
|
До начала ПВТ |
Во время ПВТ | |
| Пег-ИФН |
Высокая биохимическая активность (АЛТ > 2-5 ВГН) Высокая гистологическая активность (≥A2) Генотипы A и B HBV по сравнению с генотипами D и C Отсутствие ИФН-терапии в анамнезе |
При HBeAg-позитивном ХГВ HBe-сероконверсия ассоциирована со следующими факторами: Снижение ДНК HBV < 20 000 МЕ/мл через 12 недель (50%-й вероятность) Увеличение активности АЛТ после снижения уровня HBV ДНК Снижение уровня HBsAg < 1500 МЕ/мл через 12 недель Уровень HBeAg через 24 недели При HBeAg-негативном ХГВ стойкий ответ ассоциирован со следующими факторами: Снижение концентрации ДНК HBV < 20 000 МЕ/мл через 12 недель (50% вероятность) Снижение уровня HBsAg |
| АН |
При HBeAg-позитивном ХГВ HBe-сероконверсия ассоциирована со следующими факторами: Высокая активность АЛТ и высокая гистологическая активность |
Независимо от HBeAg-статуса низкий риск развития резистентности вируса, а также HBe-сероконверсия у HBeAg-позитивных пациентов ассоциированы со следующими факторами: Вирусологический ответа на 12 неделе Вирусологический ответ (неопределяемый уровень HBV ДНК) на 24 неделе |
Во время проведения ПВТ осуществляется стандартный мониторинг в целях оценки ее эффективности и безопасности (Таблица №12) .
Таблица №12 . Мониторинг ПВТ
| Исследования | Кратность | |
| Пег-ИФН | АН | |
| ОАК с подсчетом тромбоцитов | Каждые 2 недели в первый месяц, далее каждые 4 недели | Каждые 12 недель |
|
АЛТ, АСТ, Билирубин Альбумин, МНО |
Каждые 4 недели | Каждые 12 недель |
| Креатинин / клиренс креатинина, Мочевина | Каждые 12 недель | У пациентов с низким риском почечных осложнений* каждые 12 недель в первый год лечения, далее - каждые 24 недели при отсутствии ухудшения). У пациентов с высоким риском почечных осложнений* - каждые 4 недели в первые 3 месяца, далее каждые 12 недель до конца первого года лечения, далее - каждые 24 недели (при отсутствии ухудшения). При клиренсе креатинина менее 60 мл/мин или уровне фосфатов сыворотки менее 2 мг/дл целесообразна более частая оценка |
| Фосфаты | ||
|
ОАМ |
Каждые 12 недель | |
| ТТГ | Каждые 12 недель | |
| АФП | Каждые 24 недели у пациентов без ЦП, каждые 12 недель у пациентов с ЦП | |
| УЗИ ОБП | Каждые 24 недели у пациентов без ЦП, каждые 12 недель у пациентов с ЦП | Каждые 24 недели у пациентов без ЦП, каждые 12 недель у пациентов с ЦП |
| Осмотр глазного дна | Каждые 12 недель | |
| HBV DNA (качественный тест, при положительном результате - количественный | На 12, 24 и 48 неделях ПВТ и через 24 и 48 недель после ее окончания | Каждые 12 недель для подтверждения вирусологического ответа и далее каждые 12-24 недели во время ПВТ и после ее прекращения (при фиксированном курсе) |
| HBeAg / anti-HBe (у исходно HBeAg-позитивных пациентов) | На 24 и 48 неделях ПВТ и через 24 и 48 недель после ее окончания | Каждые 24 недели во время ПВТ и после ее прекращения (при фиксированном курсе) |
| HBsAg (количественный тест) | На 12 и 24 неделях ПВТ | |
| HBsAg (качественный тест) / anti-HBs | Каждые 48 недель после сероконверсии HBeAg и негативации HBV ДНК у HBeAg-позитивных пациентов или негативации HBV ДНК у HBeAg-негативных пациентов | Каждые 48 недель после сероконверсии HBeAg и негативации HBV ДНК у HBeAg-позитивных пациентов или негативации HBV ДНК у HBeAg-негативных пациентов во время ПВТ и после ее завершения (при фиксированном курсе) |
| Другие исследования (в зависимости от сопутствующих заболеваний и побочных явлений) | По показаниям | По показаниям |
*Декомпенсированный ЦП, клиренс креатинина менее 60 мл/мин, плохо контролируемая артериальная гипертензия, протеинурия, неконтролируемый сахарный диабет, активный гломерулонефрит, сопутствующая терапия нефротоксичными препаратами, трансплантация солидного органа
Виды ответа на ПВТ :
Биохимический ответ - нормализация АЛТ
Гистологический ответ - снижение ИГА ≥ 2 пунктов (HAI, Ishak) без прогрессирования фиброза
Серологический ответ (клиренс / сероконверсия HBsAg; клиренс / сероконверсия HBeAg у HBeAg-позитивных пациентов)
Вирусологический ответ отличается в зависимости от ПВТ (Таблица №13)
Таблица №13
. Виды вирусологического ответа
|
Препараты |
Виды вирусологического ответа | Определение |
| ПЕГ-ИФН | Вирусологический ответ | Концентрация HBV ДНК < 2000 МЕ/мл (оценивается на 6 месяце, в конце лечения, а также через 6 и 12 месяцев после окончания терапии) |
| Отсутствие вирусологического ответа | Концентрация HBV ДНК > 2000 МЕ/мл (оценивается на 6 месяце терапии, в конце лечения) | |
| Устойчивый вирусологический ответ | Уровень HBV ДНК < 2000 МЕ/мл спустя 12 месяцев после прекращения лечения | |
| Полный ответ | Устойчивый вирусологический ответ после ПВТ в сочетании с клиренсом HBsAg | |
| АН | Первичное отсутствие ответа | Снижение концентрации HBV ДНК < 1 log10 МЕ/мл от первоначального через 3 месяца после начала терапии; основная причина - резистентность |
| Вирусологический ответ | Отсутствие (неопределяемый уровень) HBV ДНК по данным высокочувствительной ПЦР (оценивается каждые 3-6 месяцев во время лечения) | |
| Снижение уровня ДНК HBV > 1 log10 МЕ/мл при наличии определяемой HBV ДНК через 6 месяцев после начала терапии | ||
| Вирусологический рецидив | Подтвержденное повышение уровня HBV ДНК > 1 log10 МЕ/мл по сравнению с наименьшим уровнем ДНК HBV, достигнутым на фоне лечения; основные причины - низкая приверженность к лечению и резистентность вируса | |
| Резистентность | Селекция мутантных штаммов HBV с заменами аминокислот в обратной транскриптазе, которые приводят к снижению чувствительности вируса к АН |
Конечные точки ПВТ :
Клиренс HBsAg (с формированием и без формирования anti-HBs) у HBeAg-позитивных и HBeAg-негативных пациентов;
Устойчивый вирусологический ответ (HBV DNA < 2000 МЕ/мл) и биохимический после ПВТ у HBeAg-негативных, а также исходно HBeAg-позитивных пациентов с устойчивой сероконверсией;
Вирусологическая ремиссия (сохраняющийся отрицательный результат HBV-ДНК при использовании чувствительной ПЦР) во время длительной ПВТ у HBeAg-позитивных пациентов, не достигших сероконверсии, а также у HBeAg-негативных пациентов
ПВТ на основе Пег-ИФН проводится фиксированным курсом (48 недель). ПВТ на основе АН также может проводится фиксированным курсом при достижении конечных точек (в основном, в случаях HBeAg-позитивного гепатита без ЦП). При отсутствии достижения конечных точек при НBeAg-позитивном гепатите, в большинстве случаев HBeAg-негативного гепатита, а также во всех случаях ЦП независимо от HBeAg-статуса, терапия АН проводится неопределенно долго (Таблица №14).
Таблица №14
. Длительность ПВТ в зависимости от режима и достижения конечных точек
| Препараты | HBeAg-позитивные пациенты | HBeAg-негативные пациенты | ||
| Конечные точки | Длительность / тактика ПВТ | Конечные точки | Длительность / тактика ПВТ | |
| Пег-ИФН* |
Стойкая сероконверсия HBeAg с одновременным снижением HBV ДНК< 2000 МЕ/мл и нормализацией АЛТ |
. 48 недель |
HBV ДНК < 2000 МЕ/мл (в идеале - неопределяемая HBV ДНК) В идеале - в сочетании с клиренсом / сероконверсией HBsAg |
. 48 недель |
| АН |
сероконверсия HBeAg с неопределяемой HBV ДНК и нормализацией АЛТ В идеале - в сочетании с клиренсом /сероконверсией HBsAg |
У пациентов без ЦП - 48 недель после сероконверсии HBeAg и неопределяемой HBV ДНК (стойкая сероконверсия сохраняется у 40-80% пациентов) |
. Клиренс / сероконверсия HBsAg с неопределяемой HBV ДНК и нормализацией АЛТ |
У пациентов без ЦП - до исчезновения HBsAg |
Неудачи терапии
Мониторинг терапии ХГВ, помимо достижения конечных точек, предусматривает определение промежуточных предикторов ее неэффективности, а также неудач, включая отсутствие ответа по окончании терапии и устойчивого вирусологического ответа (при фиксированных курсах), первичное отсутствие ответа, частичный вирусологический ответ и вирусологический прорыв (при длительных курсах) . Терапевтическая тактика в этих случаях представлена в Таблице №15.
Таблица №15 . Неудачи ПВТ и тактика при них
| Препараты |
Период |
Показатели неэффективности | Тактика | |
| HBeAg-позитивные пациенты | HBeAg-негативные пациенты | |||
| Пег-ИФН | 12 (24) неделя ПВТ | HBsAg > 20,000 МЕ/мл или не снижается и HBV ДНК не снижается или снижается менее чем на 2 log10 МЕ/мл | HBsAg не снижается и HBV ДНК не снижается или снижается менее чем на 2 log10 МЕ/мл | . Рассмотреть вопрос об отмене Пег-ИФН (особенно при генотипе D HBV) и назначении АН |
| 48 неделя (окончание) ПВТ и период последующего наблюдения | Определяется HBeAg или HBV ДНК > 2000 МЕ/мл | HBV ДНК > 2000 МЕ/мл | Рассмотреть вопрос о назначении АН | |
| АН | 12 неделя ПВТ | Первичное отсутствие ответа |
При отсутствии нарушений режима ПВТ желательно провести генотипирование штаммов HBV для выявления возможных мутаций Назначить АН с высоким генетическим барьером (тенфовир или энтекавир) в соответствии с профилем резистентности* |
|
| 24 неделя ПВТ | Частичный вирусологический ответ |
Оценить приверженность к терапии и правильность приема препарата Назначить АН с высоким генетическим барьером (тенофовир или энтекавир) в соответствии с профилем резистентности* |
||
| Любой период ПВТ | Вирусологический рецидив |
Оценить приверженность к терапии и правильность приема препарата (нарушения режима терапии особенно вероятны у пациентов, впервые получающих АН с высоким генетическим барьером - тенофовир или энтекавир) Назначить АН с высоким генетическим барьером в соответствии с профилем резистентности* При резистентности ко многим препаратам целесообразны генотипирование вируса и применение комбинации аналогов нуклеозидов и нуклеотидов (предпочтительно тенофовира) |
||
| Любой период после ПВТ (при ограниченном по времени курсе) | Рецидив | . Возобновить прием АН с высоким генетическим барьером (тенофовир или энтекавир) | ||
*в соответствии с Таблицей №16.
HBV склонен к спонтанным и медикаментозно-индуцированным мутациям - изменениям структуры ДНК в результате ошибок репликации, которые способствуют приобретению новых свойств. В результате некоторых мутаций формируется резистентность к лекарственным препаратам, что оказывает ключевое влияние на тактику ПВТ (Таблица №16) .
Таблица №16 . Резистентность на фоне терапии АН и тактика при ее развитии
| Риск развития резистентности | Тактика | |
| Ламивудин (LAM) |
1 год - 24% 2 год - 38% 3 год - 49% 4 год - 67% 5 год - 70% |
Заменить на Тенофовир |
| Телбивудин (LdT) |
1 год - 4% 2 год - 17% |
|
| Энтекавир (ETV) |
1 год - 0,2% 2 год - 0,5% 3 год - 1,2% 4 год - 1,2% 5 год - 1,2% |
Заменить на Тенофовир или добавить Тенофовир |
| Тенофовир (TDF) | Не описана | Заменить на Энтекавир у пациентов, ранее не получавших Ламивудин, или добавить Энтекавир или Телбивудин или Ламивудин или Эмтрицитабин |
Пациенты с хронической HBV-инфекцией, включая тех, кому ПВТ не проводится, нуждаются в динамическом наблюдении в целях оценки прогрессирования заболевания и скрининга ГЦК. Кратность наблюдения и перечень обследования представлены в Таблице №17.
Таблица №17
. Динамическое наблюдение за пациентами с HBV-инфекцией
| Минимальный перечень исследований | Стадия заболевания | |
| F0-F3 | F4 | |
| Общий анализ крови с подсчетом тромбоцитов | Каждые 6 месяцев | Каждые 3 месяца |
| Функциональные пробы печени (АЛТ, АСТ, билирубин, креатинин, альбумин, МНО, щелочная фосфатаза) | Каждые 6 месяцев | Каждые 3 месяца |
| АФП | Каждые 6 месяцев | Каждые 3 месяца |
| УЗИ органов брюшной полости | Каждые 6 месяцев | Каждые 3 месяца |
| ПЦР: HBV ДНК (качественный тест, при положительном результате - количественный) | Каждые 6 месяцев | Каждые 3 месяца |
| anti-HDV | Каждые 6 месяцев | Каждые 6 месяцев |
| Другие исследования | Исследования, проводимые при ЦП по показаниям | |
Тактика в отдельных группах
Пациенты с суперинфекцией HDV
У всех пациентов с ХГВ должен проводиться скрининг на HDV (дельта)-инфекцию (определение anti-HDV)
При коинфекции HBV и HDV развивается острый гепатит, склонный с саморазрешению, но с более частыми фулминантными формами (по сравнению с моноинфекцией HBV)
При суперинфекции HDV чаще (до 90%) развивается хронический гепатит D, характеризующийся быстропрогрессирующим течением, высоким риском развития ЦП и ГЦК (4 и 2,8 % в год соответственно). Активная дельта-инфекция подтверждается наличием анти-HDV IgM и HDV РНК
Бессимптомные носители HDV с нормальной АЛТ, отсутствием гистологической активности и стадией заболевания < F2 нуждаются в мониторинге
ПВТ при ХГD проводится в соответствии со следующими положениями:
− Лечение показано пациентам с повышенной активностью трансаминаз и/или гистологической активностью, а также со стадией заболевания ≥ F2 по шкале METAVIR (согласно данным непрямой эластометрии или гистологического исследования), при этом лечение начинают как можно раньше
− Эффективность ПВТ может быть оценена на 3-6 месяце с помощью ПЦР, при этом отсутствие определяемого уровня HDV РНК на 6 месяце является прогностически благоприятным фактором достижения вирусологического ответа
− Имеются сведения о преимуществах пролонгации терапии свыше 1 года, однако, оптимальная длительность ПВТ до настоящего момента не определена
− У 25-30% пациентов по окончании лечения отмечается вирусологический ответ с неопределяемой HDV RNA и улучшением гистологии, а у некоторых - еще и потеря HBsAg, однако, во многих случаях наблюдается рецидив в первые 6 месяцев, а также в последующий период (поздний рецидив), в связи с чем термин «Устойчивый вирусологический ответ» не может использоваться применительно к HDV-инфекции
− В соответствии с результатами исследования HIDIT-2, у пациентов с ЦП вирусологический ответ выше, чем у пациентов без ЦП (51% vs 25%), при этом частота развития побочных явлений достоверно выше при ЦП
− В соответствии с результатами исследований HIDIT-1 и HIDIT-2, комбинация Пег-ИФН и АН не улучшает результаты терапии
− АН не влияют на репликацию HDV и ассоциированное заболевание. Тем не менее, терапия АН может быть рассмотрена у пациентов с активной репликацией HBV с постоянным или флюктуирующим уровнем HBV ДНК >2000 IU/ml (при ЦП - с определяемым уровнем HBV ДНК), особенно в случае неэффективности или невозможности применения Пег-ИФН.
Пациенты с коинфекцией HCV
У всех пациентов с ХГВ должен проводиться скрининг на ВГС (определение anti-HCV)
HCV - коинфекция ускоряет прогрессирование заболевания печени и повышает риск ГЦК
Уровень HBV ДНК чаще низкий или даже неопределяемый, а HCV вносит основной вклад в активность гепатита и прогрессирование заболевания
Показания к терапии ХГВ и ХГС определяются в соответствии со стандартными рекомендациями, однако, данная категория пациентов является приоритетной для инициации ПВТ
В случае реактивации HBV показана терапия АН.
Пациенты с коинфекцией ВИЧ
У всех пациентов с ХГВ должен проводиться скрининг на ВИЧ (anti-HIV)
У ВИЧ-инфицированных пациентов с ХГВ повышен риск ЦП и ГЦК
Антиретровирусная терапия может приводить к реактивации ХГВ в связи с восстановлением иммунного ответа
Показания к терапии ХГВ соответствуют таковым для пациентов без ВИЧ-инфекции
Большинство пациентов с коинфекцией ВИЧ нуждается в одновременном лечении обеих инфекций с использованием комбинации Тенофовира с Эмтрицитабином или Ламивудином в сочетании с третьим компонентом, активным в отношении ВИЧ (во избежание развития резистентности)
У некоторых пациентов с числом CD4 > 500/мкл можно рассмотреть вопрос лечения ХГВ до начала антиретровирусной терапии. При этом используются Пег-ИФН или Телбивудин, не активные против ВИЧ и не вызывающие развитие резистентности ВИЧ. В случае отсутствия достижения неопределяемого уровня HBV ДНК в течение 12 месяцев, назначают комбинированную терапию обеих инфекций, как указано выше.
Острый гепатит В
В некоторых случаях дифференцировать острый гепатит В от реактивации хронического гепатита крайне сложно и может потребоваться проведение гистологического исследования
Острый гепатит В склонен к саморазрешению с сероконверсией и формированием anti-HBs более чем у 95 % взрослых
При фулминантных формах показаны трансплантация печени и прием АН, при этом назначение Пег-ИФН противопоказано
Оптимальная длительность терапии АН не установлена, однако целесообразно продолжать ПВТ не менее 3 месяцев после HBsAg- сероконверсии или не менее 12 месяцев после HBeAg-сероконверсии без исчезновения HBsAg.
Профилактическое лечение при проведении иммуносупрессивной терапии
Во время иммуносупрессивной терапии (ИСТ), применяемой в лечении аутоиммуных и онкологических заболеваний, а также при проведении трансплантации костного мозга или солидных органов, имеется риск реактивации хронической HBV-инфекции
До начала ИСТ пациентам необходимо провести маркерную диагностику гепатита В
В случае положительных результатов на HBsAg и/или анти-HBc должны быть проведены следующие исследования:
− анти-HBs
− уровень ДНК HBV (качественный, количественный тесты)
− Функциональные пробы печени.
Тактика ведения пациентов в зависимости от результатов этих тестов представлена в Таблице №18.
Таблица №18
. Тактика профилактической ПВТ у пациентов, получающих ИСТ
|
HBsAg |
anti-HBc | anti-HBs |
HBV ДНК |
ИСТ | Тактика |
| + | > 2000 МЕ/мл | Тенофовир или энтекавир до начала ИСТ. ПВТ должна быть продолжена на протяжении 12 месяцев после достижения сероконверсии HBeAg и неопределяемого уровня HBV ДНК | |||
| + | > 2000 МЕ/мл | Продолжительность <6 мес. | Ламивудин до начала ИСТ. Контроль уровня HBV ДНК ежемесячно. Если ДНК HBV определяется после 3 мес. ПВТ, - заменить ламивудин на тенофовир. ПВТ нужно продолжать минимум 6 мес. после окончания ИСТ | ||
| Продолжительность >6 мес | Тенофовир или энтекавир до начала ИСТ. ПВТ нужно продолжать минимум 6 мес. после окончания ИСТ | ||||
| - | + | + или -- | Ритуксимаб или другая анти В-клеточная терапия | Ламивудин до начала ИСТ. ПВТ продолжить минимум 6 месяцев после окончания ИСТ | |
| + | + | -- | Не определяется | Мониторинг ДНК HBV ежемесячно. Если HBV ДНК начинает определяться, назначить АН и продолжить ПВТ минимум 6 мес. после окончания ИСТ | |
| < 2000 МЕ/мл | Не получают ритуксимаб или другую анти В-клеточную терапию, ИСТ менее 6 мес. | Ламивудин до начала ИСТ. Если через 6 мес. ПВТ продолжает определяться HBV ДНК, ламивудин заменить на тенофовир. ПВТ продолжить минимум 6 мес. после окончания ИСТ | |||
| > 2000 МЕ/мл | Не получают ритуксимаб или другую анти В-клеточную терапию, ИСТ более 6 мес. |
Энтекавир или тенофовир до начала ИСТ. ПВТ продолжить минимум 6 мес. после окончания ИСТ |
|||
| - | + | + | Не определяется | Не получают ритуксимаб или другую анти В-клеточную терапию | Профилактическая ПВТ не показана |
Кроме того, у HBsAg-негативных реципиентов печени от анти-HBc-позитивных доноров требуется профилактика АН (энтекавиром, тенофовиром, ламивудином), которая должна проводиться неопределенно долго.
Медицинские работники
В целях снижения риска передачи HBV-инфекции во время инвазивных процедур медицинским работникам может потребоваться ПВТ по особым показаниям
В случаях хронической HBV-инфекции с уровнем ДНК ≥ 2000 МЕ/мл целесообразна стандартная ПВТ
В случае применения АН предпочтительны препараты с высоким генетическим барьером (тенофовир или энтекавир), обеспечивающие достижение неопределяемого уровня HBV ДНК (в идеале) либо его снижение до менее чем 2000 МЕ/мл.
Планирование беременности и беременность
Медицинская помощь женщинам, планирующим беременность, а также беременным с хронической HBV-инфекцией, основывается на следующих общих положениях:
− Все женщины, обратившиеся в медицинские организации в связи с планированием беременности, а также при первом обращении для постановки на учет по беременности, в обязательном порядке подлежат обследованию на наличие HBsAg
− Беременные женщины, имеющие положительный результат скрининга на HBsAg, должны быть направлены на консультацию к гастроэнтерологу или инфекционисту, практикующим лечение вирусных гепатитов
− Оценка тяжести заболевания печени у беременных с хронической HBV-инфекцией соответствует таковой в общей популяции, за исключением проведения непрямой эластометрии
− Наличие хронической HBV-инфекции при компенсированном состоянии печени и отсутствии осложнений (гиперспленизм, варикозное расширение вен пищевода, желудка и другие признаки портальной гипертензии) не является противопоказанием для наступления беременности, естественного родоразрешения и кормления грудью
− Во время беременности следует проводить динамическое наблюдение за течением HBV-инфекции, включая регулярное (каждые 1-2 месяца) исследование общего анализа крови с подсчетом тромбоцитов и функциональных проб печени (АЛТ, АСТ, билирубин, альбумин, креатинин, МНО, щелочная фосфатаза), а также определение показателей, требуемых в случае назначения ПВТ
− Показания к ПВТ по поводу хронической HBV-инфекции у беременных, в целом, соответствуют таковым в общей популяции, однако, имеются противопоказания по применению ряда препаратов
− В конце 2 триместра беременности необходимо исследовать вирусную нагрузку для определения показаний к ПВТ в целях профилактики перинатальной трансмиссии
− Пег-ИФН абсолютно противопоказан, ламивудин и энтекавир по влиянию на беременность отнесены FDA к категории C, а тенофовир и телбивудин - к категории B (классификация основана на данных о тератогенности, полученных в доклинических исследованиях). При беременности предпочтительно использовать препараты категории В.
− До начала терапии HBV-инфекции следует обсудить вопросы планирования семьи, при этом женщина должна получить исчерпывающую информацию о безопасности и рисках препаратов в случае их приема во время беременности и кормления грудью
− Ребёнку, рождённому женщиной с HBV-инфекцией, в первые 8 часов после родов должна быть проведена активная (вакцина) и пассивная (HBIg) иммунизация против вирусного гепатита В в соответствии с инструкциями по применению зарегистрированных в РК препаратов
− У женщин с хронической HBV-инфекцией имеется риск реактивации гепатита в постнатальном периоде, особенно после отмены ранее назначенной ПВТ, в связи с чем таким женщинам целесообразно ежемесячное исследование функциональных проб печени как минимум на протяжении 6 месяцев после родов.
Женщины репродуктивного возраста с хронической HBV-инфекцией могут принадлежать к следующим группам:
− Женщины, планирующие беременность
− Беременные, не получающие ПВТ
− Женщины с беременностью, наступившей во время ПВТ
Тактика у женщин с хронической HBV-инфекцией, планирующих беременность, заключается в следующем:
− При отсутствии показаний к противовирусной терапии пациентка подлежит динамическому наблюдению
− В случае отсутствия активного заболевания печени и стадии менее F3 возможна отсрочка терапии до рождения ребенка
− При наличии активного заболевания печени со стадией F3 и выше (тяжелом фиброзе и циррозе) у женщин, которые согласны отложить запланированную беременность, целесообразно провести курсовое лечение Пег-ИФН, при этом следует помнить о необходимости эффективной контрацепции во время лечения. В случае невозможности или неэффективности терапии Пег-ИФН, а также в случае планирования беременности в ближайшее время, показана терапия АН, которую рекомендуется продолжать во время наступившей беременности и после нее, при этом тенофовир представляется наиболее рациональным выбором
Тактика у беременных с хронической HBV-инфекцией, не получавших ПВТ, заключается в следующем:
− При отсутствии показаний к противовирусной терапии и вирусной нагрузке HBV ДНК менее 1 000 000 МЕ/мл пациентка подлежит динамическому наблюдению
− В случае стадии заболевания печени менее F3 и вирусной нагрузке HBV ДНК менее 1 000 000 МЕ/мл возможна отсрочка терапии до рождения ребенка
− В случае отсутствия активного заболевания печени, стадии менее F3 и высокой вирусной нагрузке HBV ДНК (1 000 000 МЕ/мл и выше), особенно при HBeAg-позитивном статусе, имеется высокий риск вертикального заражения (10%), несмотря на активную и пассивную иммунизацию ребенка. Таким женщинам в целях профилактики перинатальной трансмиссии в течение всего 3 триместра назначают АН (тенофовир или телбивудин или ламивудин). Контрольное определение HBV ДНК проводят через 8 недель, а прием препаратов рекомендуют продолжить в течение 12 недель после родов. В дальнейшем необходимость в ПВТ определяется по общим показаниям
− В случае наличия активного заболевания печени с тяжелым фиброзом или циррозом показана стандартная ПВТ с использованием препаратов категории В, из которых наиболее предпочтителен тенофовир. По общим показаниям терапию продолжают после родов
Тактика у женщин с беременностью, наступившей во время ПВТ по поводу ХГВ, заключается в следующем:
− В случаях, когда пациентка во время беременности продолжает принимать назначенные ранее противовирусные препараты, показания к терапии HBV-инфекции должны быть пересмотрены
− В случае отсутствия тяжелого фиброза или цирроза и вирусной нагрузки HBV ДНК менее 1 000 000 МЕ/мл строгих показаний для продолжения противовирусной терапии нет и пациентка подлежит динамическому наблюдению
− В случае применения у пациентки с тяжелым фиброзом или циррозом печени противовирусных препаратов, относящихся к категории В, терапия ими должна быть продолжена во время беременности и по общим показаниям - после родов
− В случае применения при тяжелом фиброзе или циррозе печени противовирусных препаратов, противопоказанных при беременности, пациентку следует проинформировать о возможных рисках влияния данных препаратов на плод. В дальнейшем при сохранении беременности их следует заменить на препараты категории В, из которых предпочтителен тенофовир в связи с его большей активностью, высоким порогом резистентности и доступной информацией по безопасности у беременных женщин. По общим показаниям терапию продолжают после родов.
Реципиенты почки и пациенты на гемодиализе
Все реципиенты почки и пациенты на гемодиализе подлежат обязательному исследованию на наличие HBsAg
Серонегативным пациентам (с отрицательными результатами маркерной диагностики) требуется вакцинация против вирусного гепатита В
Пациентам с хронической болезнью почек, имеющим ХГВ, возможно проведение ПВТ с использованием Пег-ИФН и АН, при этом необходима коррекция доз препаратов в соответствии с инструкцией по применению
У пациентов, перенесших трансплантацию почки, Пег-ИФН противопоказан и проведение ПВТ возможно только с использованием АН. Данная терапия должна быть назначена даже при отсутствии активного заболевания печени всем HBsAg-позитивным реципиентам, получающим ИСТ, в целях профилактики реактивации HBV-инфекции
Во время ПВТ необходим регулярный мониторинг функции почек для своевременной коррекции режима терапии.
Пациенты с циррозом печени
Каждому пациенту с ЦП в исходе ХГВ определяются показания к ТП на основе стандартных оценочных шкал (CTP, MELD)
При компенсированном ЦП в исходе ХГВ ПВТ проводится независимо от вирусной нагрузки в стандартном режиме с использованием Пег-ИФН и АН
При декомпенсированном ЦП в исходе ХГВ Пег-ИФН противопоказан. ПВТ проводится АН, назначаемыми независимо от вирусной нагрузки, при этом следует иметь ввиду риск развития лактат-ацидоза (особенно на фоне терапии энтекавиром), что требует проведения тщательного клинико-лабораторного мониторинга
ПВТ на основе АН при ЦП назначается на длительный период времени с регулярным (каждые 3 месяца) мониторинге HBV ДНК для своевременной коррекции терапии в случае ее неудачи
В лечении ЦП среди АН предпочтительны тенофовир и энтекавир в виде монотерапии в связи с их высокой противовирусной активностью и минимальным риском резистентности; у пациентов с клиренсом креатинина менее 50 мл/мин дозы АН должны быть снижены в соответствии с инструкцией по применению
Всем пациентам с ЦП, независимо от статуса терапии и ее эффективности, включая случаи достижения устойчивого вирусологического ответа и вирусологической ремиссии, обязателен регулярный (1 раз в 3 месяца) скрининг на ГЦК, с учетом существующего риска.
Пациенты после ТП по поводу HBV-ассоциированных заболеваний печени
Всем пациентам с планируемой ТП по поводу HBV-ассоциированных заболеваний печени в до- и посттрансплантационном периоде требуется ПВТ с использованием АН, предпочтительно, 1 линии
(менее 100% вероятности применения):
|
МНН |
Форма выпуска |
| Ламивудин | Таблетки, покрытые пленочной оболочкой, 100 мг |
| Телбивудин | Таблетки, покрытые пленочной оболочкой, 600 мг |
| Энтекавир | Таблетки диспергируемые 0,5 мг |
| Эпоэтин альфа | |
| Эпоэтин бета | 2000 МЕ 15 |
| Филграстим | 30 млн.ЕД |
| Парацетамол | таблетки 500 мг |
| Левотироксин натрия | таблетки 25 мкг |
| Левотироксин натрия | |
| Ламивудин | Таблетки, покрытые пленочной оболочкой, 100 мг |
| Телбивудин | Таблетки, покрытые пленочной оболочкой, 600 мг |
| Энтекавир | Таблетки диспергируемые 0,5 мг |
| Эпоэтин альфа | раствор для инъекций в готовых к употреблению шприцах 2000 МЕ/0,5 мл 15 |
| Эпоэтин бета | 2000 МЕ 15 |
| Филграстим | 30 млн.ЕД |
| Парацетамол | таблетки 500 мг |
| Левотироксин натрия | таблетки 25 мкг |
| Левотироксин натрия | таблетки 50 мкг |
| Левотироксин натрия | таблетки 50 мкг |
| Адаметионин | лиофилизированный порошок, 500 мг |
| Тромбоконцентрат | в/в |
Медикаментозное лечение, оказываемое на этапе скорой неотложной помощи: нет.
Другие виды лечения: нет.
Хирургическое вмешательство: нет.
Профилактические мероприятия:
Обязательная вакцинация против гепатита В всем новорожденным и декретированным группам
Ранняя вакцинация новорожденных от HBsAg-позитивных матерей вакциной против гепатита В и иммуноглобулином человека против гепатита В (HBIG) в соответствии с инструкциями зарегистрированных в РК препаратов
Использование барьерных контрацептивов (презервативов) при контактах HBsAg - позитивных лиц с сексуальными партнерами, не имеющих HBV-инфекции, постинфекционного либо поствакцинального иммунитета.
Показания для плановой госпитализации:
Выраженная активность заболевания;
Декомпенсация заболевания печени (включая осложнения цирроза печени в исходе хронического вирусного гепатита В);
Пункционная биопсия печени;
Начальный период противовирусной терапии у пациентов с прогнозируемыми побочными явлениями средней и тяжелой степени;
Побочные явления в результате противовирусной терапии (цитопении, инфекции, психоневрологические нарушения и другие побочные явления средней и тяжелой степени);
Определение показаний и обследование перед трансплантацией печени.
Информация
Источники и литература
- Протоколы заседаний Экспертного совета РЦРЗ МЗСР РК, 2015
- 1. EASL Clinical Practice Guidelines: Management of chronic hepatitis B virus infection. Journal of Hepatology, 2012 vol. 57 p. 167–185. 2. NICE clinical guideline: Diagnosis and management of chronic hepatitis B in children, young people and adults//June 2013. 3. The Korean Association for the Study of the Liver (KASL) Clinical Practice Guidelines: Management of chronic hepatitis B. Clin Mol Hepatol Volume_18 Number_2 June 2012. 4. Sherlock"s Diseases of the Liver and Biliary System 12th Edition by James S. Dooley (Editor), Anna Lok (Editor), Andrew K. Burroughs (Editor), Jenny Heathcote (Editor), 2011. 5. Management of chronic hepatitis B: Canadian Association for the Study of the Liver consensus guidelines, Carla S Coffin MD MSc, FRCPC, Scott K Fung MD, FRCPC, Mang M Ma MD, FRCPC, Can J Gastroenterol Vol 26 No 12, December 2012. 6. American Association for the Study of Liver Diseases: Liver Biopsy, Don C. Rockey, Stephen H. Caldwell, Zachary D. Goodman, Rendon C. Nelson, and Alastair D. Smith. Hepatology, March 2009. 7. Noninvasive models of liver fibrosis, Zeng et al. Croat Med J. 2015;56:272-9 doi: 10.3325/cmj.2015.56.272. 8. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J.Hepatol (2015), http://dx.doi.org/10.1016/j.jhep.2015.04.006. 9. Wong GL, Wong VW, Choi PC, Chan AW, Chan HL. Development of a noninvasive algorithm with transient elastography (Fibroscan) and serum test formula for advanced liver fibrosis in chronic hepatitis B. Aliment Pharmacol Ther 2010;31:1095–1103. 10. Wong GL, Chan HL, Choi PC, Chan AW, Yu Z, Lai JW, et al. Non-invasive algorithm of enhanced liver fibrosis and liver stiffness measurement with transient elastography for advanced liver fibrosis in chronic hepatitis B. Aliment Pharmacol Ther 2014;39:197–208. 11. Comparison of Diagnostic Accuracy of Aspartate Aminotransferase to Platelet Ratio Index and Fibrosis-4 Index for Detecting Liver Fibrosis in Adult Patients With Chronic Hepatitis B Virus Infection: A Systemic Review and Meta-analysis, Xiao et al. Hepatology, January 2015. 12. Kim HC, Nam CM, Jee SH, Han KH, Oh DK, Suh I. Normal serum aminotransferase concentration and risk of mortality from liver diseases: prospective cohort study. BMJ 2004;328:983. 13. Prati D, Taioli E, Zanella A, Della Torre E, Butelli S, Del Vecchio E, et al. Updated definitions of healthy ranges for serum alanine aminotransferase levels. Ann Intern Med 2002;137:1-10. 14. Kariv R, Leshno M, Beth-Or A, Strul H, Blendis L, Kokia E, et al. Reevaluation of serum alanine aminotransferase upper normal limit and its modulating factors in a large-scale population study. Liver Int 2006;26:445-450. 15. Polish HBV Expert Group, Therapeutic recommendations for 2013: antiviral treatment for chronic hepatitis B. Przegl epidemiol 2013; 67: 287 – 295. 16. Kao JH, Wu NH, Chen PJ, Lai MY, Chen DS. Hepatitis B genotypes and the response to interferon therapy. J Hepatol 2000;33:998-1002. 17. Keeffe EB, Dieterich DT, Han SH, Jacobson IM, Martin P, Schiff ER, et al. A treatment algorithm for the management of chronic hepatitis B virus infection in the United States: 2008 update. Clin Gastroenterol Hepatol 2008;6:1315-1341. 18. Wedemeyer H, Yurdaydin C, Dalekos GN, Erhardt A, Cakaloglu Y, Degertekin H, et al. Peginterferon plus adefovir versus either drug alone for hepatitis delta. N Engl J Med 2011;364:322–331. 19. Yurdaydin C, Idilman R, Bozkaya H, Bozdayi AM. Natural history and treatment of chronic delta hepatitis. J Viral Hepat 2010;17:749–75. 20. Papatheodoridis GV, Manolakopoulos S, Touloumi G, Vourli G, Raptopoulou-Gigi M, Vafiadis-Zoumbouli I, et al. Virological suppression does not prevent the development of hepatocellular carcinoma in HBeAg-negative chronic hepatitis B patients with cirrhosis receiving oral antiviral(s) starting with lamivudine monotherapy: results of the nationwide HEPNET. Greece cohort study. Gut 2011;60:1109–1116. 21. Gunson RN, Shouval D, Roggendorf M, Zaaijer H, Nicholas H, Holzmann H, et al. Hepatitis B virus (HBV) and hepatitis C virus (HCV) infections in health care workers (HCWs): guidelines for prevention of transmission of HBV and HCV from HCW to patients. J Clin Virol 2003;27:213–230. 22. Bzowej NH, Hepatitis B. Therapy in pregnancy. Curr Hepat Rep 2010;9:197–204. 23. Xu WM, Cui YT, Wang L, Yang H, Liang ZQ, Li XM, et al. Lamivudine in late pregnancy to prevent perinatal transmission of hepatitis B virus infection: a multicentre, randomized, double-blind, placebo-controlled study. J Viral Hepat 2009;16:94–103. 24. Han GR, Cao MK, Zhao W, Jiang HX, Wang CM, Bai SF, et al. A prospective and open-label study for the efficacy and safety of telbivudine in pregnancy for the prevention of perinatal transmission of hepatitis B virus infection. J Hepatol 2011;55:1215–1221.
Информация
III. ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков протокола с указание квалификационных данных:
1) Нерсесов Александр Витальевич - доктор медицинских наук, профессор, заведующий кафедрой гастроэнтерологии и гепатологии с курсом эндоскопии, руководитель отдела гастроэнтерологии и гепатологии РГП на ПХВ «Научно - исследовательский институт кардиологии и внутренних болезней», Председатель Казахской Ассоциации по изучению печени, член Европейской, Американской, Азиатско-Тихоокеанской Ассоциации по изучению печени, Японского общества гепатологов
2) Калиаскарова Кульпаш Сагындыковна - доктор медицинских наук, профессор кафедры АО «Медицинский университет Астана», главный внештатный гастроэнтеролог МЗСР РК.
3) Доскожаева Сауле Темирбулатовна - доктор медицинских наук, профессор АО «Казахский медицинский университет непрерывного образования», проректор по учебной и научной работе, заведующая кафедрой инфекционных болезней.
5) Конысбекова Алия Анапьяровна - гастроэнтеролог, АО «Республиканский диагностический центр».
6) Калиева Мира Маратовна - клинический фармаколог, доцент кафедры клинической фармакологии и фармакотерапии РГП на ПХВ «Казахский национальный медицинский университет имени С.Д Асфендиярова».
Указание на отсутствие конфликта интересов:
нет.
Рецензенты:
1. Маевская Марина Викторовна - доктор медицинских наук, заведующая отделением гепатологии, Клиники пропедевтики внутренних имени В.Х. Василенко Первого Московского медицинского университета имени И.М. Сеченова, Вице президент российского общества по изучению печени.
2. Кошерова Бахыт Нургалиевна - доктор медицинских наук, профессор, проректор по клинической работе и НПР РГП на ПХВ «Карагандинский государственный медицинский университет»:
3. Рахметова Венера Саметовна -доктор медицинских наук, руководитель отдела гепатологии, АО «Национальный научный медицинский центр»
Прием предложений (с заполненной формой обоснования) идет до 29 марта 2019 года: [email protected] , [email protected] , [email protected]
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement, не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement является исключительно информационно-справочным ресурсом. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.
Внепеченочные проявления хронической HBV инфекции.
Приблизительно у 10-20% больных встречаются внепеченочные проявления хронической HBV инфекции. Считается, что они вызываются циркулирующими иммунными комплексами, хотя их истинное происхождение окончательно не известно.
Сывороточная болезнь. Иногда начало острого гепатита В подобно сывороточной болезни с лихорадкой, артралгиями, артритами и кожной сыпью. При кожной и суставной манифестации болезни быстро присоединяется желтуха.
Нодозный периартериит. У 10 – 50% больных с нодозным периартериитом обнаруживается HВsAg. Иммунные комплексы, содержащие антигены и антитела к HBV, рассматриваются в качестве триггера поражения сосудов. В патологический процесс могут вовлекаться крупные, средние и мелкие артерии с поражением сердечно-сосудистой системы (перикардит, артериальная гипертензия, сердечная недостаточность), почек (гематурия, протеинурия), гастроинтестинального тракта (васкулит мезентериальных сосудов с болями в животе), костно-мышечной системы (артралгии и артриты), нервной системы (мононевриты или поражения ЦНС), кожи (сыпь).
Гломерулонефрит. HBV-опосредованный гломерулонефрит чаще встречается у детей. Морфологически это мембранозная, мембранознопролиферативная формы или IgA-опосредованная нефропатия. При манифестации заболевания поражением почек изменения в печени редко бывают тяжелыми. Приблизительно у 30 – 60% детей с HBV опосредованным мембранозным гломерулонефритом развиваются спонтанные ремиссии. Лечение кортикостероидами, как правило, неэффективно и способствуют репликации HBV. Положительные результаты лечения интерфероном показаны в нескольких клинических исследованиях, но они значительно ниже у взрослых, чем у детей. Приблизительно у 30% больных заболевание может прогрессировать с развитием почечной недостаточности, в среднем, 10% из них потребуется постоянный гемодиализ.
Эссенциальная смешанная криоглобулинемия – системное заболевание с вовлечением в патологический процесс преимущественно мелких сосудов, проявляющееся гломерулонефритом, артритом и пурпурой. В криоглобулинах обнаруживают HВsAg, HВsAb и HBV-подобные частицы.
Болезнь Джанотти (папулезный акродерматит). Клинически проявляется симметричной макулопапулезной эритематозной сыпью на ногах, ягодицах, предплечьях, сохраняющейся от 15 до 20 дней, иногда сопровождающейся лимфоаденопатией. В патогенезе патологического процесса играют роль циркулирующие иммунные комплексы, содержащие HВsAg и антитела к нему. У детей эта форма заболевания всегда строго ассоциируется с выявлением HВsAg в сыворотке крови.
Апластическая анемия, ассоциированная с гепатитом, развивается по иммунопатологическому механизму и патогенетически напрямую не связана с вирусом.
Панкреатит . Отмечено повышение частоты обнаружения HВsAg у пациентов с хроническим панкреатитом при отсутствии у них клинико-лабораторных признаков острого или хронического вирусного гепатита. В протоках и ацинарных структурах поджелудочной железы обнаружены вирусные антигены – HВsAg и НВсAg. Отмечены положительные результаты при лечении больных хроническим панкреатитом в сочетании с хронической НВV-инфекцией противовирусными препаратами.
Хроническая HBV инфекция и алкоголь. Распространенность HBV инфекции среди алкоголиков в 2 – 4 раза выше, чем в общей популяции. Алкоголизм в сочетании с HBV инфекцией приводит к более тяжелому повреждению печени и способствует развитию цирроза и гепатоцеллюлярной карциномы. Продолжительность жизни неинфицированных алкоголиков выше, чем инфицированных. Однако, окончательно не известно, являются ли алкоголь и HBV независимыми повреждающими печень факторами, или действуют синергично.
Сочетание HBV с HСV или HDV. Примерно у 10 – 15% больных с ХГВ, циррозом печени или ГЦК выявляется HСV. Коинфекция HСV может удлинить инкубационный период заболевания, уменьшить срок HВsAg-емии, уменьшить пиковое значение сывороточных трансаминаз в сравнении с моноинфекцией HBV. В то же время, имеются данные о том, что острая коинфекция HСV и HBV может протекать в форме фульминантного гепатита.
Суперинфекция HCV у носителей HBsAg снижает уровень HBV DNA в сыворотке крови и ткани печени и повышает скорость сероконверсии HВsAg в anti-HBs. У большинства пациентов с двойной инфекцией (HBV и HCV) в сыворотке крови можно выявить HCV RNA, а не HBV DNA, что свидетельствует о способности вируса гепатита С подавлять репликацию HBV и определять течение болезни. Поражение печени у лиц с двойной инфекцией обычно тяжелее, чем при моноинфекции вирусом гепатита В. У этих больных чаще, чем при инфицировании одним вирусом, развивается гепатоцеллюлярная карцинома.
Острая коинфекция HBV и HDV протекает более тяжело, чем моноинфекция HBV и чаще приводит к фульминантному течению гепатита. Суперинфекция HDV у пациентов с хронической HBV инфекцией обычно сопровождается прекращением (супрессией) репликации HBV. Большинство исследователей полагают, что HDV суперинфекция приводит к более тяжелому повреждению печени и прогрессированию в цирроз, другие авторы это мнение не разделяют.
HВV инфекция и гепатоцеллюлярная карцинома. Повсеместно ГЦК занимает третье место по смертности от онкологических заболеваний среди мужчин и седьмое место среди женщин. Чаще всего эта форма рака встречается в эндемичных для HВV зонах.
Лечение.
Основные цели лечения ХГВ:
· предупреждение развития осложнений длительно существующей инфекции;
· снижение смертности;
· улучшение субъективного самочувствия больных;
· элиминация HBV DNА;
· положительная сероконверсия HBeAg в anti-HBe;
· нормализация АЛАТ сыворотки крови;
· гистологическое уменьшение степени воспалительной активности печеночного процесса.

